题目内容
实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: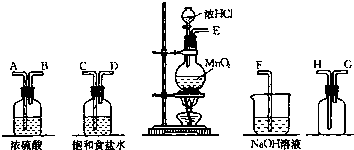
(1)盛放浓盐酸的玻璃仪器的名称是 .
(2)连接上述仪器的正确顺序是(填各接口处的字母): 接 , 接 ,
接 , 接 .
(3)①饱和食盐水的作用 ,②浓硫酸起的作用是 .
(4)化学实验中如果将Cl2通入蒸馏水中,得到 色的溶液,写出反应方程式 .该溶液中含有多种微粒,其中,显示颜色的微粒是(填微粒符号,下同) ,具有漂白性的微粒是 ,与硝酸银溶液反应产生白色沉淀的微粒是 ,显酸性的微粒是 .
(5)①气体发生装置中进行的反应化学反应方程式是: ;
②NaOH溶液的作用是: ,反应的化学方程式是: .

(1)盛放浓盐酸的玻璃仪器的名称是
(2)连接上述仪器的正确顺序是(填各接口处的字母):
(3)①饱和食盐水的作用
(4)化学实验中如果将Cl2通入蒸馏水中,得到
(5)①气体发生装置中进行的反应化学反应方程式是:
②NaOH溶液的作用是:
考点:氯气的实验室制法
专题:
分析:(1)根据实验仪器的特点确定名称;
(2)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(3)根据氯气中混有氯化氢杂质,借助进行除杂的原则进行回答;浓硫酸具有吸水性的性质来回答;
(4)氯气可以和水反应生成盐酸和次氯酸,根据氯水的成分来确定氯水的各种微粒具有的性质;
(5)氯气可以用二氧化锰和浓盐酸在加热的条件下发生反应制得,氯气有毒,污染环境,可以用氢氧化钠进行尾气处理.
(2)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(3)根据氯气中混有氯化氢杂质,借助进行除杂的原则进行回答;浓硫酸具有吸水性的性质来回答;
(4)氯气可以和水反应生成盐酸和次氯酸,根据氯水的成分来确定氯水的各种微粒具有的性质;
(5)氯气可以用二氧化锰和浓盐酸在加热的条件下发生反应制得,氯气有毒,污染环境,可以用氢氧化钠进行尾气处理.
解答:
解:(1)盛放浓盐酸的仪器是分液漏斗,故答案为:分液漏斗;
(2)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,段导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气.
故答案为:E,C,D,A,B,H,G,F;
(3)氯气中混有氯化氢杂质,氯化氢能溶于饱和食盐水中,但是氯气不溶,可以用饱和食盐水除去氯气中的氯化氢气体;浓硫酸具有吸水性,可以吸收氯气中的水分,故答案为:除去氯气中的氯化氢气体;干燥氯气;
(4)氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,氯气溶于水,得到氯水,氯水中因为含有氯气分子而导致溶液显示浅黄绿色,含有次氯酸分子而具有漂白性,含有氯离子,能和硝酸银溶液反应生成氯化银白色沉淀,含有氢离子,导致氯水显示酸性,
故答案为:浅黄绿色;Cl2+H2O=HCl+HClO;Cl2;HClO;Cl-;H+;
(5)①用二氧化锰和浓盐酸在加热的条件下发生反应可以制得氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
②氯气有毒,污染环境,可以用氢氧化钠进行尾气处理,发生的反应为:Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
(2)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,段导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气.
故答案为:E,C,D,A,B,H,G,F;
(3)氯气中混有氯化氢杂质,氯化氢能溶于饱和食盐水中,但是氯气不溶,可以用饱和食盐水除去氯气中的氯化氢气体;浓硫酸具有吸水性,可以吸收氯气中的水分,故答案为:除去氯气中的氯化氢气体;干燥氯气;
(4)氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,氯气溶于水,得到氯水,氯水中因为含有氯气分子而导致溶液显示浅黄绿色,含有次氯酸分子而具有漂白性,含有氯离子,能和硝酸银溶液反应生成氯化银白色沉淀,含有氢离子,导致氯水显示酸性,
故答案为:浅黄绿色;Cl2+H2O=HCl+HClO;Cl2;HClO;Cl-;H+;
(5)①用二氧化锰和浓盐酸在加热的条件下发生反应可以制得氯气:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
②氯气有毒,污染环境,可以用氢氧化钠进行尾气处理,发生的反应为:Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评:本题涉及氯气的制取原理、漂白粉的制备、氯水的性质以及氯气的检验等知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
下列有关实验操作的叙述不正确的是( )
| A、用干燥、洁净的玻璃棒醮取待测液滴在 pH试纸(置于表面皿内)上测溶液的pH |
| B、烧瓶、锥形瓶、烧杯加热时都要垫石棉网 |
| C、制备Fe(OH)3胶体时,应往沸水中加饱和FeC13溶液,并继续加热至溶液呈现红褐色为止 |
| D、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
下列化学方程式或离子方程式正确的是( )
| A、乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O | ||
B、甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2
| ||
C、实验室用液溴和苯在催化剂作用下制溴苯: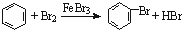 | ||
D、将CO2通入苯酚钠溶液: |
下列说法正确的是( )
| A、CO2的水溶液能导电,所以CO2是电解质 |
| B、BaSO4不溶于水,其水溶液很难导电,所以BaSO4是非电解质 |
| C、液氯不导电,所以液氯是非电解质 |
| D、氯化氢的水溶液能导电,所以氯化氢是电解质 |
下面的排序不正确的是( )
| A、金属Cu中Cu原子堆积方式为面心立方最密堆积,每个Cu原子的配位数均为12 |
| B、晶体的熔点:SiC>CCl4>P4>SO2 |
| C、酸性:HClO4>HClO3>HClO |
| D、晶格能由大到小:NaF>NaCl>NaBr>NaI |
用NA表示阿伏伽德罗常数,下列说法不正确的是( )
| A、2mol SO2和1mol O2在一定条件下反应,反应后分子总数大于2NA |
| B、25℃,在pH=2的1.0L H2SO4溶液中含有H+数目为0.01NA |
| C、在二氧化硅的晶体中,1mol SiO2含有Si-O键数目为NA |
| D、25mL 18mol?L-1浓硫酸与足量Zn反应,转移电子数为0.225NA |
下列说法正确的是( )
| A、物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 |
| B、100 mL 1 mol?L-1的盐酸和50 mL 2 mol?L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 |
| C、100 mL pH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 |
| D、100 mL pH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
