题目内容
 【化学反应原理(选修4)】
【化学反应原理(选修4)】(1)NaHCO3和Na2CO3可用于面食制作和油污清洗.
①常温下0.1mol?L-1 NaHCO3溶液呈
②用Na2CO3溶液清洗油污时,加热可以增强去污能力,是由于升温
Na2CO3水解,使溶液pH增大.
(2)C(s)与H2O(g)反应生成1molCO(g)和1molH2(g)吸收131.5kJ热量.该反应的热化学方程式为
A.C+H2O=CO+H2△H=+131.5kJ?mol-1
B.C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5KJ
C.C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5KJ?mol-1
(3)一定温度和压强下,可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)在密闭容器中达到平衡,请回答下列问题:
①若增大H2O(g)的浓度,则CO的转化率
②若降低温度,平衡向正反应方向移动,则正反应为
③若加入催化剂,则平衡
A.不移动 B.向正反应方向移动 C.向逆反应方向移动
(4)钢铁是目前用量最大、用途最广的金属材料,但钢铁容易生锈.
①某同学取一颗光亮的铁钉按图甲装置实验,数天后,试管内的现象是
A.铁钉不生锈,液面上升
B.铁钉生锈,液面上升
C.铁钉生锈,液面下升
②铁表面镀锌可以增强铁的耐腐蚀性.铁片镀锌装置的原理示意图如图乙,铁片作
考点:盐类水解的应用,金属的电化学腐蚀与防护,化学平衡的影响因素,金属与合金在性能上的主要差异
专题:化学平衡专题,盐类的水解专题,电化学专题
分析:(1)①碳酸氢钠中碳酸根离子水解程度大于电离程度导致其溶液中碱性,钠离子不水解,据此判断钠离子和碳酸氢根离子浓度相对大小;
②盐类水解是吸热反应,升高温度平衡向吸热反应方向移动;
(2)热化学方程式要标明物质的状态、焓变,且焓变的单位是kJ/mol;
(3)①增大反应物浓度平衡向正反应方向移动B;
②降低温度,平衡向放热反应方向移动;
③催化剂不改变平衡移动.
(4)①弱酸性或中性溶液中,铁钉发生吸热反应;
②电镀时,镀层作阳极、镀件作阴极,电解质溶液中含有与镀层相同金属元素的离子.
②盐类水解是吸热反应,升高温度平衡向吸热反应方向移动;
(2)热化学方程式要标明物质的状态、焓变,且焓变的单位是kJ/mol;
(3)①增大反应物浓度平衡向正反应方向移动B;
②降低温度,平衡向放热反应方向移动;
③催化剂不改变平衡移动.
(4)①弱酸性或中性溶液中,铁钉发生吸热反应;
②电镀时,镀层作阳极、镀件作阴极,电解质溶液中含有与镀层相同金属元素的离子.
解答:
解:(1)①碳酸氢钠中碳酸根离子水解程度大于电离程度导致其溶液中碱性,钠离子不水解,所以C(Na+)>C(HCO3-),故答案为:碱;>;
②盐类水解是吸热反应,升高温度平衡向吸热反应方向移动,所以升高温度促进水解,故答案为:促进;
(2)热化学方程式要标明物质的状态、焓变,且焓变的单位是kJ/mol,
A.该选项中没有标明物质的状态,故错误;
B.该选项中焓变的单位错误,故错误;
C.该选项符合热化学反应方程式的特点,故正确;
故选C;
(3)①若增大H2O(g)的浓度,平衡向正反应方向移动,则CO的转化率增大,故答案为:增大;
②若降低温度,降低温度平衡向放热反应方向移动,平衡向正反应方向移动,则正反应为放热反应,故答案为:放热;
③若加入催化剂,催化剂只改变反应速率不改变平衡移动,所以平衡不移动,故选A;
(4)①中性条件下,铁钉发生吸氧腐蚀,所以铁钉生锈,氧气和铁转化为氢氧化铁,导致试管内气体压强减小,则试管内液面上升,故选B;
②铁片镀锌,则铁作阴极、锌作阳极,锌片上锌失电子生成锌离子进入溶液,电极反应式为Zn-2e-=Zn2+,故答案为:阴;Zn-2e-=Zn2+.
②盐类水解是吸热反应,升高温度平衡向吸热反应方向移动,所以升高温度促进水解,故答案为:促进;
(2)热化学方程式要标明物质的状态、焓变,且焓变的单位是kJ/mol,
A.该选项中没有标明物质的状态,故错误;
B.该选项中焓变的单位错误,故错误;
C.该选项符合热化学反应方程式的特点,故正确;
故选C;
(3)①若增大H2O(g)的浓度,平衡向正反应方向移动,则CO的转化率增大,故答案为:增大;
②若降低温度,降低温度平衡向放热反应方向移动,平衡向正反应方向移动,则正反应为放热反应,故答案为:放热;
③若加入催化剂,催化剂只改变反应速率不改变平衡移动,所以平衡不移动,故选A;
(4)①中性条件下,铁钉发生吸氧腐蚀,所以铁钉生锈,氧气和铁转化为氢氧化铁,导致试管内气体压强减小,则试管内液面上升,故选B;
②铁片镀锌,则铁作阴极、锌作阳极,锌片上锌失电子生成锌离子进入溶液,电极反应式为Zn-2e-=Zn2+,故答案为:阴;Zn-2e-=Zn2+.
点评:本题考查较综合,涉及金属的腐蚀与防护、盐类水解、热化学反应方程式、化学平衡等知识点,熟悉原电池和电解池原理、盐类水解特点、影响化学平衡移动的因素等知识点即可解答,注意:催化剂能同等程度的改变正逆反应速率,所以不影响平衡移动,为易错点.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
下列化学反应中,属于氧化还原反应的是( )
| A、SO2+2OH-=SO32-+H2O |
| B、Al2O3+2OH-=2AlO2-+H2O |
| C、Cl2+2OH-=Cl-+ClO-+H2O |
| D、HCO3-+OH-=CO32-+H2O |
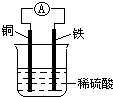 如图为铜铁原电池示意图,下列有关说法正确的是( )
如图为铜铁原电池示意图,下列有关说法正确的是( )| A、铜棒逐渐溶解 |
| B、该装置能将电能转化为化学能 |
| C、电子由铁棒通过导线流向铜棒 |
| D、正极反应为Fe-2e-=Fe2+ |
能正确表示下列化学变化的离子方程式是( )
| A、钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、氯气与溴化钠溶液反应:Cl2+2Br-=Br2+2Cl- |
| C、氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- |
| D、三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- |
阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是( )
| A、标准状况下,0.4gH2含氢分子数为0.2×6.02×1023 |
| B、32g O2中含有的氧原子数为2×6.02×1023 |
| C、1mol Na2O2与足量水反应转移电子数为6.02×1023 |
| D、标准状况下,22.4L H2O含水分子数为6.02×1023 |