题目内容
4.某元素卤化物,在一条件下其卤化物呈气态时,其密度是相同状况氢气密度的95倍;该元素在其卤化物中的质量分数为25.2%,而此元素在同价态的氧化物中占60%;此元素的原子核中,质子数和中子数之比为11:13.(1)通过计算写出元素卤化物的化学式TiCl4.
(2)判断它在元素周期表中位置第四周期IVB族.
分析 某元素卤化物的相对分子质量为95×2=190,卤化物中该元素原子数目为1,设卤化物为AXn,则该元素相对原子质量为190×25.2%=48,令质子数为Z,则$\frac{Z}{48-Z}$=$\frac{11}{13}$,解得Z=22,故该元素为Ti,同价态氧化物中Ti、O原子数目之比为$\frac{60%}{48}$:$\frac{1-60%}{16}$=1:2,则氧化物为TiO2,故卤化物中Ti为+4价,再结合相对分子质量计算卤元素的相对原子质量确定分子式.
解答 解:(1)某元素卤化物的相对分子质量为95×2=190,卤化物中该元素原子数目为1,则该元素相对原子质量为190×25.2%=48,令质子数为Z,则$\frac{Z}{48-Z}$=$\frac{11}{13}$,解得Z=22,故该元素为Ti,
同价态氧化物中Ti、O原子数目之比为$\frac{60%}{48}$:$\frac{1-60%}{16}$=1:2,则氧化物为TiO2,故卤化物中Ti为+4价,设卤化物为TiX4,则卤素原子的相对原子质量为$\frac{190-48}{4}$=35.5,故该卤素为硫元素,化学式为TiCl4,
故答案为:TiCl4;
(2)该元素为Ti,处于第四周期IVB族,
故答案为:第四周期IVB族.
点评 本题考查元素化合物的推断,属于金属性推断,关键是对卤化物概念的理解,掌握化学式的有关计算.

练习册系列答案
相关题目
14.据报道,摩托罗拉公司研制了一种有甲醇和氧气,以及强碱作电解质的手机电池,电量可达到镍氢电池的10倍,有关此电池的叙述错误的是( )
| A. | 溶液中的阳离子移向正极 | |
| B. | 负极反应式:CH3OH+8OH--6e-═C+6H2O | |
| C. | 电池在使用过程中,电解质溶液的c(OH-)不变 | |
| D. | 当外电路通过6 mol电子时,理论上消耗1.5 mol O2 |
12.下列物质在一定条件下能发生水解反应,且水解产物能发生银镜反应的是( )
| A. | 葡萄糖 | B. | 淀粉 | C. | 蔗糖 | D. | 乙酸乙酯 |
2.在一定条件下,$RO_3^{n-}$和I-发生反应的离子方程式为:$RO_3^{n-}$+6I-+6H+=R-+3I2+3H2O(R为主族元素)则:R元素最外层电子数为( )
| A. | 7 | B. | 5 | C. | 3 | D. | 4 |
19.下列叙述不正确的是( )
| A. | 液氨汽化吸热,故液氨常做制冷剂 | |
| B. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| C. | 浓硝酸和浓硫酸与铜反应都能表现出强氧化性和酸性 | |
| D. | 实验室可用氯化铵固体与氢氧化钠固体共热制氨气 |



 .
.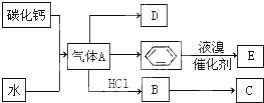
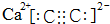 ;D的空间构型为平面结构,键角为120°;
;D的空间构型为平面结构,键角为120°; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应 其反应类型为加聚反应
其反应类型为加聚反应 .
.