题目内容
19.下列叙述不正确的是( )| A. | 液氨汽化吸热,故液氨常做制冷剂 | |
| B. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| C. | 浓硝酸和浓硫酸与铜反应都能表现出强氧化性和酸性 | |
| D. | 实验室可用氯化铵固体与氢氧化钠固体共热制氨气 |
分析 A.液氨汽化吸收大量的热;
B.作为食品的保鲜措施,需选用性质稳定且成本低的物质,氮气来源广泛且性质稳定;
C.与铜反应时,分别生成硝酸铜、二氧化氮和水;硫酸铜、二氧化硫和水;
D.氢氧化钠碱性较强易腐蚀实验仪器,导致仪器破损.
解答 解:A.液氨汽化吸收大量的热,可使环境温度降低,能够做制冷剂,故A正确;
B.填充保护气是向其中充入性质稳定,不能与食品发生反应,无毒无味,并且廉价易得的不能供给呼吸的气体,氮气来源广泛且性质稳定常用作保护气,故B正确;
C.Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,酸中(S、N)元素的化合价部分变化,还生成盐,则都表现出强氧化性和强酸性,故C正确;
D.实验室用氢氧化钙和氯化铵固体加热制备氨气,氢氧化钠碱性较强易腐蚀实验仪器,导致仪器破损,故D错误;
故选D.
点评 本题考查了元素化合物知识,熟悉浓硝酸、浓硫酸的性质、氨气的实验室制备原理是解题关键,注意知识的积累,题目难度不大,注意对基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列物质含有的化学键类型完全相同的是( )
| A. | NaBr和H2O | B. | Na2O和Na2O2 | C. | D2O和CO2 | D. | NH4Cl和HCl |
14.铝土矿是工业炼铝的主要原料,某铝土矿样品组成如下:
主要成分:Al2O3杂质:Fe2O3、SiO2及其他不溶且不参与化学反应的物质为测定该样品中Al的含量,某化学兴趣小组设计了如下两个方案:
【查阅资料】各相关离子开始沉淀和沉淀完全时溶液的pH如表:
方案一:将铝土矿加足量盐酸溶解,再调节pH,使Fe3+沉淀完全而Al3+不沉淀.需调节pH范围应是3.2~3.4,若想得到氯化铝固体需将其溶液通入HCl气流中直至蒸干.
方案二:

(1)②反应的离子方程式为OH-+CO2=CO32-+H2O,2AlO2-+CO2+3H2O=CO32-+2Al(OH)3↓.CO2不可过量的原因是防止SiO32-被沉淀.
(2)若在步骤②中加入乙酸乙酯调节pH,加热也可得到d的沉淀,写出生成d沉淀的化学方程式AlO2-+CH3COOCH2CH3+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CH3COO-+Al(OH)3↓+CH3CH2OH.
主要成分:Al2O3杂质:Fe2O3、SiO2及其他不溶且不参与化学反应的物质为测定该样品中Al的含量,某化学兴趣小组设计了如下两个方案:
【查阅资料】各相关离子开始沉淀和沉淀完全时溶液的pH如表:
| Al3+ | Fe3+ | AlO2- | SiO32- | |
| 开始沉淀时 | 3.4 | 1.9 | 10.6 | 7.3 |
| 沉淀完全时 | 4.7 | 3.2 | 9.3 | 5.3 |
方案二:

(1)②反应的离子方程式为OH-+CO2=CO32-+H2O,2AlO2-+CO2+3H2O=CO32-+2Al(OH)3↓.CO2不可过量的原因是防止SiO32-被沉淀.
(2)若在步骤②中加入乙酸乙酯调节pH,加热也可得到d的沉淀,写出生成d沉淀的化学方程式AlO2-+CH3COOCH2CH3+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CH3COO-+Al(OH)3↓+CH3CH2OH.
4.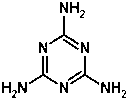 2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )
2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )
 2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )
2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )| A. | 三聚氰胺属于芳香族化合物,但不属于芳香烃 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 三聚氰胺中的碳原子属于饱和碳原子 | |
| D. | 三聚氰胺分子中的所有原子都在一个平面内 |
11.将等体积的SO2和Cl2气混和后通入含有石蕊的水中,溶液的颜色将( )
| A. | 褪色 | B. | 仍为紫色 | C. | 变红 | D. | 变蓝 |
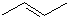 某有机物X的键线式为
某有机物X的键线式为 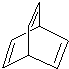
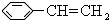 ,该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程
,该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程 .
.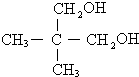 .
.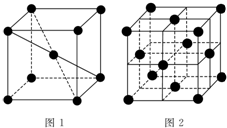 1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.
1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.