题目内容
6.某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
请回答下列问题:
(1)B装置的名称是(球型)干燥管;E装置的作用除去氯气中的氯化氢.
(2)写出F中发生反应的离子反应方程式4H++2Cl-(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑.
(3)上述制氨为快速制氨,实验室常用氯化铵和氢氧化钙制备,其化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O.
(4)装置A的烧瓶中装有生石灰,随着浓氨水的滴入,氨气产生的原因是生石灰吸水放热,温度升高,促进了氨气的逸出.
(5)通入C装置的两根导管左边较长、右边较短,目的是使密度大的氯气与密度小的氨气较快地均匀混合.
(6)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:3C12+8NH3=N2+6NH4Cl当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(用含a、b的代数式表示)$\frac{b}{2a}$mol-1.
分析 (1)熟悉仪器形状说出其名称;浓盐酸具有挥发性,制备的氯气中含有氯化氢,依据氯气、氯化氢的溶解性选择除杂剂;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(3)氯化铵与固体氢氧化钙在加热条件下反应生成氯化钙、氨气和水;
(4)浓氨水滴入生石灰,氧化钙和水反应放热,一水合氨分解生成氨气;
(5)根据氨气和氯气的密度大小以及保证二者充分混合的方法来回答;
(6)氨气与氯气发生氧化还原反应生成氮气和氯化氢,过量的氨气与氯化氢反应生成固体氯化铵;根据公式NA=$\frac{N}{n}$进行计算.
解答 解:(1)图中B为(球型)干燥管; 浓盐酸具有挥发性,制备的氯气中含有氯化氢,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以用饱和食盐水可以除去氯气中的氯化氢;
故答案为:(球型)干燥管;除去氯气中的氯化氢;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式:4H++2Cl-(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;
故答案为:4H++2Cl-(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;
(3)氯化铵与固体氢氧化钙在加热条件下反应生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
(4)烧瓶内盛有生石灰,浓氨水滴入生石灰,氧化钙和水反应放热,一水合氨分解生成氨气,
故答案为:生石灰吸水放热提供OH-促进了氨气的逸出;
生石灰吸水放热,温度升高,促进了氨气的逸出
(5)氨气密度比氯气的小,通入C装置的两根导管左边较长(导氨气)、右边较短(导氯气),可以保证二者充分混合,
故答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(6)过量的氯气可以和氨气之间反应生成氮气和氯化铵,即3Cl2+8NH3═N2+6NH4Cl,当有3mol氯气参加反应时,转移的电子为6mol,当有n mol氯气参加反应时,转移的电子为2n mol,个数是N=2n•NA,所以NA=$\frac{N}{2a}$=$\frac{b}{2a}$mol-1,
故答案为:3C12+8NH3=N2+6NH4Cl;$\frac{b}{2a}$mol-1.
点评 本题考查了氨气、氯气的实验室制备及性质,明确氨气、氯气制备原理及二者性质是解题关键,题目难度不大.

| A. | 1:9 | B. | 1:1 | C. | 1:2 | D. | 1:4 |
| A. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 向三氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═A1(OH)3↓+3NH4+ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
| A. | NaAlO2溶液中通入少量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | NaOH溶液中通入少量二氧化碳:2OH-+CO2═CO32-+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
| A. | 1.98 kg | B. | 2.00 kg | C. | 2.22 kg | D. | 2.42 kg |
| A. | 1:1:1 | B. | 1:2:3 | C. | 6:3:2 | D. | 2:3:6 |
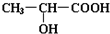
 .
.