题目内容
11.下列各组离子在给定条件下能大量共存的是( )| A. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
分析 A.pH=1的溶液,显酸性,离子之间发生氧化还原反应;
B.离子之间结合生成沉淀;
C.离子之间发生氧化还原反应;
D.c(H+)=1.0×10-13mol•L-1的溶液,显碱性.
解答 解:A.pH=1的溶液呈酸性,ClO-与氢离子反应生成弱酸,H+、ClO-、Cl-发生氧化还原反应,不能大量共存,故A错误;
B.Ba2+与SO42-反应生成沉淀而不能大量共存,故B错误;
C.有NO3-存在的强酸性溶液具有强氧化性,具有还原性的Fe2+、Br-不能大量共存,故C错误;
D.c(H+)=1.0×10-13mol/L的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
2.常用FeCl3溶液作为印刷电路板时的“腐蚀液”,其反应为2FeCl3+Cu═2FeCl2+CuCl2.向FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
| A. | 烧杯中固体有铁、无铜 | B. | 烧杯中固体有铜、无铁 | ||
| C. | 烧杯中固体铁、铜都有 | D. | 烧杯中固体铁、铜都无 |
19.下列有关工业生产的叙述中错误的是( )
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
16.甲烷和氨在国民经济中占有重要地位.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
①反应热△H(填“>”、“<”或“=”)<0.
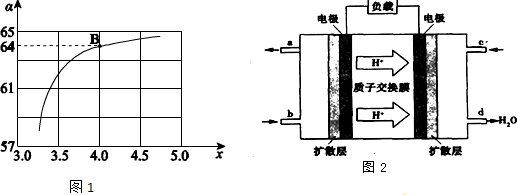
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.
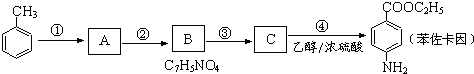
(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.

(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
3.下列离子方程式错误的是( )
| A. | 氯气通入水中:C12+H2O?H++C1-+HClO | |
| B. | 向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3+CaCO3↓+2H2O | |
| C. | 将适量的CO2通入Ca(C1O)2溶液中:Ca2++2C1O-+CO2+H2O═2HC1O+CaCO3↓ | |
| D. | Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
20.某溶液可使紫色石蕊溶液变红,向其中加人BaCl2溶液,有白色沉淀生成,该溶液中可能含有下列离子中的( )
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | Al3+ | D. | NO3- |
 .
.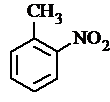 、
、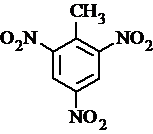 等
等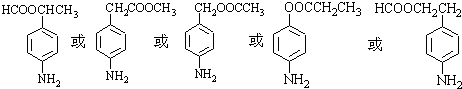 .
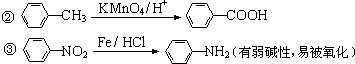
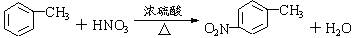
.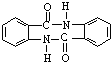 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下: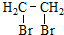

 Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.