题目内容
3.在下列条件下,两种气体的分子数一定相等的是( )| A. | 同密度、同压强的CO和C2H4 | B. | 同温度、同体积的O2和N2 | ||
| C. | 同体积、同密度的C2H4和N2 | D. | 同压强、同体积的O2和N2 |
分析 两种气体的分子数一定相等,则气体的物质的量一定相等,以此来解答.
解答 解:A.体积未知,质量无法确定,不能得出物质的量的关系,故A错误;
B.压强未知,物质的量的关系不确定,故B错误;
C.同体积、同密度,m=ρV,质量相同,且摩尔质量相同,则物质的量相同,分子数相同,故C正确;
D.温度未知,物质的量关系不确定,故D错误;
故选C.
点评 本题考查阿伏伽德罗定律及推论,明确物质的量相同是解答的关键,注意各个量之间的关系,题目难度不大.

练习册系列答案
相关题目
9.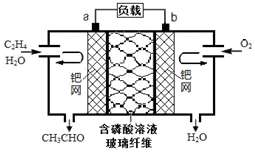 乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )
乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )
 乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )
乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )| A. | 该电池可实现化学能与电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 放电时,电路中每转移0.4mol电子,溶液中就有0.4molH+向负极迁移 | |
| D. | 该电池的负极反应式为:CH2═CH2-2e-+H2O=CH3CHO+2H+ |
14.下列药品保存方法正确的是( )
| A. | 短期保存Br2:盛于磨口的细口瓶中,并用水封,瓶盖严密 | |
| B. | 锂、钠、钾都保存在煤油中,密封 | |
| C. | 氨水、浓盐酸易挥发必须保存在棕色磨口细口瓶中 | |
| D. | 红磷无需密封保存 |
11.下列各组离子一定能大量共存的是( )
| A. | 在强碱性溶液中:Na+、K+、[Al(OH)4]-、CO32- | |
| B. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在c(H+)=10-13mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
8.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | c(H+)=10-6mol/L纯水 | |
| C. | 使石蕊试液呈紫色的溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
15.在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(s),所得实验数据如下表:下列说法不正确的是( )
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | n(N) | ||
| ① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
| ② | 800 | 0.20 | 0.80 | a | a |
| ③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
| A. | 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=12.5 | |
| C. | 实验②中,达到平衡时,a大于0.16 | |
| D. | 正反应为放热反应 |
12.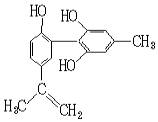 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 有机物分子式为C16H14O3 | |
| B. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| C. | 1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 滴入KMnO4(H+)溶液,观察紫色褪去,可证明结构中存在碳碳双键 |
13.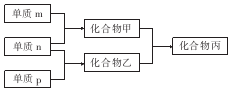 短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
 短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )| A. | X是同周期中非金属性最强的元素 | |
| B. | 元素X、Y、Z的原子半径大小关系为X<Y<Z | |
| C. | Z的氧化物的水化物的酸性在主族元素中最强 | |
| D. | 化合物丙是离子化合物,既含离子键又含共价键 |