题目内容
下列说法不正确的是( )
| A、工业上冶炼Fe用热还原方法 |
| B、海水淡化的方法主要有蒸馏法,电渗析法,离子交换法等 |
| C、工业上通过煤的干馏可获得芳香烃 |
| D、单质硅是将太阳能转变为电能的材料,二氧化硅可以做半导体材料 |
考点:金属冶炼的一般原理,海水资源及其综合利用,硅和二氧化硅,煤的干馏和综合利用
专题:化学应用
分析:A、Fe通常采用一氧化碳还原氧化铁的还原法冶炼;
B、根据海水淡化的主要方法分析;
C、煤干馏是将煤加热到900~1100℃时,可以得到焦炭、煤焦油、煤气等物质;
D、单质硅可用于制作太阳能电池的原料,属于半导体材料.
B、根据海水淡化的主要方法分析;
C、煤干馏是将煤加热到900~1100℃时,可以得到焦炭、煤焦油、煤气等物质;
D、单质硅可用于制作太阳能电池的原料,属于半导体材料.
解答:
解:A、工业上用一氧化碳还原氧化铁冶炼Fe,属于热还原方法,故A正确;
B、海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故B正确;
C、煤的干馏是指煤在隔绝空气的条件下加热,生成煤焦油、焦炭、焦炉煤气等物质,可以得到甲烷、煤焦油中含有苯和氨等重要化工原料,故C正确;
D、单质硅可用于制作太阳能电池的原料,属于半导体材料,二氧化硅不可以做半导体材料,可以做光导纤维材料,故D错误.
故选D.
B、海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故B正确;
C、煤的干馏是指煤在隔绝空气的条件下加热,生成煤焦油、焦炭、焦炉煤气等物质,可以得到甲烷、煤焦油中含有苯和氨等重要化工原料,故C正确;
D、单质硅可用于制作太阳能电池的原料,属于半导体材料,二氧化硅不可以做半导体材料,可以做光导纤维材料,故D错误.
故选D.
点评:本题考查学生物质的性质和应用等方面的知识,属于化学的实际应用题,难度不大,注意知识的归纳和整理是关键.

练习册系列答案
相关题目
下列对有机物结构或性质的描述,错误的是( )
| A、一定条件下,C12可在甲苯的苯环或侧链上发生取代反应 |
B、2-甲基丙烯的结构简式: |
| C、乙醇和乙烯的混合物l mol,完全燃烧消耗3 mol O2 |
| D、光照下2,2-二甲基丁烷与Br2反应,其一溴取代物只有2种 |
正在火星上工作的美国“勇气”号、“机遇”号探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O.以下叙述正确的是( )
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
下列叙述不正确的是( )
| A、纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B、氢氧燃料电池是一种将化学能转化为电能的装置 |
| C、可用浸有酸性高锰酸钾溶液的滤纸来检验二氧化硫气体的漂白性 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
a、b、c、d是四种短周期的主族元素.其中d的质子数最大,a、b、d同周期;a、c同主族. a的原子结构示意图为: ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: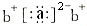 .下列叙述正确的是( )
.下列叙述正确的是( )
 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: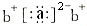 .下列叙述正确的是( )
.下列叙述正确的是( )| A、原子半径:a>c>d |
| B、非金属性:c>a>d |
| C、相应氢化物的沸点:d>c>a |
| D、c与a、c与b均能形成两种化合物 |
下列关于电负性的叙述中不正确的是( )
| A、电负性用来描述不同元素的原子对键合电子吸引力的大小 |
| B、电负性是以氟为4.0、锂为1.0作为标准的相对值 |
| C、元素电负性越小,元素非金属性越强 |
| D、元素电负性越大,元素非金属性越强 |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
设NA表示阿伏加德罗常数的值,下列关于0.2mol/L Ba(NO3)2溶液的叙述不正确的是( )
| A、2 L溶液中阴阳离子总数为1.2NA |
| B、500 mL溶液中NO3-浓度为0.2 mol/L |
| C、500 mL溶液中Ba2+浓度为0.2 mol/L |
| D、500 mL溶液中NO3-物质的量为0.2 mol |