题目内容
下列叙述正确的是( )
| A、乙酸所有原子处于同一平面,含有羧基,可与NaHCO3溶液反应生成CO2 |
| B、苯、乙醇和乙酸都能发生取代反应,乙酸乙酯和食用植物油均可水解生成乙醇 |
| C、乙烯、苯和聚乙烯都能使溴水褪色,褪色的原因相同 |
| D、在烃类有机物分子中,含有的氢原子个数一定是偶数 |
考点:有机化学反应的综合应用
专题:有机反应
分析:A.乙酸分子中含有甲基;
B.苯环上氢可被取代,乙醇的羟基可发生取代反应,乙酸乙酯的水解为乙醇,食用植物油为油脂,水解生成丙三醇.
C.根据其结构分析,碳碳双键能使溴水褪色,单键不能使溴水褪色,苯与溴水发生萃取;
D.碳原子能够形成4对共用电子对,则烃类中含有的氢原子数目一定为偶数.
B.苯环上氢可被取代,乙醇的羟基可发生取代反应,乙酸乙酯的水解为乙醇,食用植物油为油脂,水解生成丙三醇.
C.根据其结构分析,碳碳双键能使溴水褪色,单键不能使溴水褪色,苯与溴水发生萃取;
D.碳原子能够形成4对共用电子对,则烃类中含有的氢原子数目一定为偶数.
解答:
解:(1)乙酸分子中含有甲基与相连碳形成四面体,故A错误;
B.苯环上氢可被取代,乙醇的羟基可发生取代反应,乙酸乙酯的水解为乙醇,食用植物油为油脂,水解生成丙三醇,故B错误;
碳原子能够形成4个共价键,烃类中每增加一个碳碳键,减少2个H原子,所以烃分子中氢原子数目一定为偶数,故B正确;
C.乙烯与溴水发生加成反应,苯与溴水发生萃取,则褪色原理不同,聚乙烯中只有单键,所以聚乙烯不能使溴水褪色,故C错误;
D.碳原子能够形成4对共用电子对,则烃类中含有的氢原子数目一定为偶数,故D正确;
故选:D.
B.苯环上氢可被取代,乙醇的羟基可发生取代反应,乙酸乙酯的水解为乙醇,食用植物油为油脂,水解生成丙三醇,故B错误;
碳原子能够形成4个共价键,烃类中每增加一个碳碳键,减少2个H原子,所以烃分子中氢原子数目一定为偶数,故B正确;
C.乙烯与溴水发生加成反应,苯与溴水发生萃取,则褪色原理不同,聚乙烯中只有单键,所以聚乙烯不能使溴水褪色,故C错误;
D.碳原子能够形成4对共用电子对,则烃类中含有的氢原子数目一定为偶数,故D正确;
故选:D.
点评:本题考查有机物的组成、结构、性质与鉴别,题目难度不大,注意常见有机物的性质的异同.

练习册系列答案
相关题目
下列有关生产、生活中的叙述正确的是( )
| A、煤经过气化和液化两个物理变化,可变为清洁能源 |
| B、古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 |
| C、明矾可用于水的消毒、杀菌:碳酸钡可用于钡餐透视 |
| D、单晶硅太阳能电池板可以将太阳能直接转变为电能 |
分子式为C5H12O的醇与C5H10O2的酸发生酯化反应最多可形成多少种酯( )
| A、8种 | B、16种 |
| C、24种 | D、32种 |
下列对有机物结构或性质的描述,错误的是( )
| A、一定条件下,C12可在甲苯的苯环或侧链上发生取代反应 |
B、2-甲基丙烯的结构简式: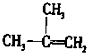 |
| C、乙醇和乙烯的混合物l mol,完全燃烧消耗3 mol O2 |
| D、光照下2,2-二甲基丁烷与Br2反应,其一溴取代物只有2种 |
正在火星上工作的美国“勇气”号、“机遇”号探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O.以下叙述正确的是( )
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题: