题目内容
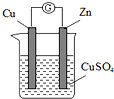 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
某实验兴趣小组按如图装置实验后,所记录内容合理的是( )| 实验 记录 | ①Cu为正极,Zn为负极; ②Zn质量减少,Cu质量不变; ③SO42- 向Cu极移动; ④电子流方向是:由Zn经导线流入Cu片; ⑤Zn电极发生还原反应; ⑥正极反应式:Cu2++2e-═Cu |
| A、①④⑥ | B、②③④ |
| C、①②⑤ | D、③⑤⑥ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Zn-Cu原电池中,Zn作负极,发生电池反应Zn+Cu2+=Zn2++Cu,电子由负极流向正极,阳离子向正极移动,以此来解答.
解答:
解:①Zn比Cu活泼,Zn为负极,Cu为正极,故①正确;
②铜为正极,发生Cu2++2e-=Cu,铜极质量增大,故②错误;
③原电池工作时,阴离子向负极移动,故③错误;
④电子由负极流向正极,即电子由Zn电极流向Cu电极,故④正确;
⑤Zn电极发生氧化反应,故⑤错误;
⑥正极发生还原反应,电极方程式为Cu2++2e-═Cu,故⑥正确.
故选A.
②铜为正极,发生Cu2++2e-=Cu,铜极质量增大,故②错误;
③原电池工作时,阴离子向负极移动,故③错误;
④电子由负极流向正极,即电子由Zn电极流向Cu电极,故④正确;
⑤Zn电极发生氧化反应,故⑤错误;
⑥正极发生还原反应,电极方程式为Cu2++2e-═Cu,故⑥正确.
故选A.
点评:本题考查原电池,为高频考点,侧重于电极的判断、发生的电极反应、电子、离子的移动方向,注意相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
有关化学用语正确的是( )
A、-CH3(甲基)的电子式为 |
B、硝基苯的结构简式 |
| C、乙烯的结构简式CH2CH2 |
| D、乙酸的分子式C2H4O2 |
下列反应的离子方程式书写正确的是( )
| A、硫酸铝溶液中加入过量氨水 Al3++30H-═Al(OH)3↓ |
| B、NaHCO3溶液与过量的Ca(OH)2溶液反应 HCO3-+0H-+Ca2+═CaCO3↓+H2O |
| C、碳酸钙与醋酸反应 CaCO3+2H+═Ca2++CO2↑+H2O |
| D、FeI2溶液通入少量Cl2 2Fe2++Cl2═2Fe3++2Cl- |
 浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半.他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池.若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半.他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池.若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2 | 充电 |
| 放电 |
| A、电池的电解液可为LiCl水溶液 |
| B、该电池放电时,负极发生还原反应 |
| C、充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 |
| D、放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
下列有关阿伏伽德罗常数说法正确的是( )
| A、含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B、标况下,22.4L四氯化碳所含分子数大于NA |
| C、0.1mol/L的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D、0.2mol/L的H2SO4的硫酸溶液与0.1mol/L的H2SO4的硫酸溶液等质量混合溶液浓度大于0.15mol/L |
 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )| A、分子式为C7H6O5 |
| B、可发生氧化、取代和加成反应 |
| C、分子中含有两种官能团 |
| D、在水溶液中羟基和羧基均能电离出氢离子 |
对于熔融状态下进行的反应:TiCl4+4Na═4NaCl+Ti,下列说法正确的是( )
| A、该反应说明钠是强还原剂,可用于冶炼金属 |
| B、TiCl4是还原剂 |
| C、该反应也可以在水溶液中进行 |
| D、该反应中Ti元素被氧化 |