题目内容
下列有关阿伏伽德罗常数说法正确的是( )
| A、含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B、标况下,22.4L四氯化碳所含分子数大于NA |
| C、0.1mol/L的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D、0.2mol/L的H2SO4的硫酸溶液与0.1mol/L的H2SO4的硫酸溶液等质量混合溶液浓度大于0.15mol/L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.锌与浓硫酸、稀硫酸的反应方程式为:Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,根据方程式判断生成气体的物质的量;
B.标准状况下,四氯化碳为液体,液体的摩尔体积小于22.4L/mol;
C.缺少硝酸银溶液的体积,无法计算溶液中阳离子的物质的量;
D.硫酸浓度越大,密度越大,两溶液的密度不同,混合后溶液浓度小于二者浓度的平均值.
| ||
B.标准状况下,四氯化碳为液体,液体的摩尔体积小于22.4L/mol;
C.缺少硝酸银溶液的体积,无法计算溶液中阳离子的物质的量;
D.硫酸浓度越大,密度越大,两溶液的密度不同,混合后溶液浓度小于二者浓度的平均值.
解答:
解:A.浓硫酸与锌反应的方程式为Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O,0.2mol硫酸能够生成0.1mol二氧化硫气体,随着反应的进行,浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气,反应的方程式为:Zn+H2SO4=ZnSO4+H2↑,0.2mol硫酸能够失去0.2mol氢气,所以0.2mol锌与浓硫酸充分反应后生成的气体一定大于0.1mol,生成气体的分子数大于0.1NA,故A错误;
B.标况下,四氯化碳为液体,摩尔体积小于22.4L/mol,则22.4L四氯化碳的物质的量大于1mol,所含分子数大于NA,故B正确;
C.没有告诉硝酸银溶液的体积,无法计算溶液中阳离子带的电荷数目,故C错误;
D.设0.2mol/L的H2SO4的硫酸溶液的密度为x,0.1mol/L的H2SO4的硫酸溶液的密度为y,硫酸浓度越大则密度越大,所以x>y,等质量两溶液混合后,设质量为m,则混合液中硫酸的浓度为:
=
mol/L=0.1mol/L+
mol/L,
mol/L=
mol/L,由于x>y,则
mol/L<0.5mol/L,所以0.1mol/L+
mol/L,
mol/L<0.15mol/L,故D错误;
故选B.
| ||
B.标况下,四氯化碳为液体,摩尔体积小于22.4L/mol,则22.4L四氯化碳的物质的量大于1mol,所含分子数大于NA,故B正确;
C.没有告诉硝酸银溶液的体积,无法计算溶液中阳离子带的电荷数目,故C错误;
D.设0.2mol/L的H2SO4的硫酸溶液的密度为x,0.1mol/L的H2SO4的硫酸溶液的密度为y,硫酸浓度越大则密度越大,所以x>y,等质量两溶液混合后,设质量为m,则混合液中硫酸的浓度为:
0.2mol/L×
| ||||
|
0.1×(
| ||||||
|
| ||||
|
| ||||
|
| 1 | ||
1+
|
| 1 | ||
1+
|
| ||||
|
| ||||
|
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确液体的摩尔体积大于气体摩尔体积,选项D为难点,注意掌握计算方法.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列离子方程式正确的是( )
| A、在硫酸亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
B、MnO2与浓盐酸反应制取Cl2:MnO2+4HCl(浓)
| ||||
| C、过量的KHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | ||||
| D、向稀氢氧化钠溶液中通入少量CO2:OH-+CO2═HCO3- |
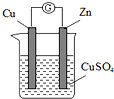 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
某实验兴趣小组按如图装置实验后,所记录内容合理的是( )| 实验 记录 | ①Cu为正极,Zn为负极; ②Zn质量减少,Cu质量不变; ③SO42- 向Cu极移动; ④电子流方向是:由Zn经导线流入Cu片; ⑤Zn电极发生还原反应; ⑥正极反应式:Cu2++2e-═Cu |
| A、①④⑥ | B、②③④ |
| C、①②⑤ | D、③⑤⑥ |
化学与生产、生活和社会密切相关,下列说法正确的是( )
| A、汽车排放的尾气和燃煤排放颗粒污染物是形成雾霾的重要因素 |
| B、为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| C、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| D、“低碳”生活倡导节能减排,禁止使用化石燃料,减少污水排放 |
实验是化学研究的基础,下列叙述正确的是( )
| A、氢气还原氧化铜,当反应完成后,先停止加热再停止通氢气 |
| B、镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火 |
| C、纯锌与稀硫酸反应产生氢气的速度较慢,加入少量CuSO4固体,速度不改变 |
| D、用AgNO3溶液直接检验溴乙烷中的溴元素 |
 熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2
熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2| 放电 |
| 充电 |
| A、放电时,a为正极,b为负极 |
| B、放电时,负极反应为:Fe2++2e-=Fe |
| C、充电时,a接外电源正极 |
| D、充电时,b极处发生氧化反应 |
下列物质一定属于同系物的是( )


| A、⑤⑦ | B、④⑥ | C、⑥⑧ | D、①③ |
从化学角度分析,下列叙述不正确的是( )
| A、SO2,NOx的排放均可导致酸雨的形成 |
| B、辽宁舰简体喷高分子膜,舰底镶嵌锌片均可用于防腐 |
| C、美国催促日本归还放射物质钚(Pu),238Pu和239Pu互为同位素 |
| D、石油的裂解和煤的干馏都是化学变化,二油脂的皂化是物理变化 |
 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题: