题目内容
5.卤代烃在生产生活中具有广泛的应用,回答下列问题:(1)甲烷与氯气的取代反应产物中结构为正四面体的是四氯化碳.工业上分离这些互溶的液态混合物的方法是分馏.
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其中一种同分异构体的结构简式CHFClCF2Br (不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
[乙烯]$→_{①}^{Cl_{2}}$[1,2-二氯乙烷]$→_{②}^{480-530℃}$[氯乙烯]$\stackrel{聚合}{→}$[聚氯乙烯]
反应①的化学方程式为H2C=CH2+Cl2→CH2ClCH2Cl,反应类型为加成反应;反应②的反应类型为消去反应.
分析 (1)分子结构为正四面体的为四氯化碳;分离互溶的液态混合物的方法是分馏;
(2)根据卤素原子的位置不同书写;
(3)乙烯与氯气发生加成反应生成1,2-二氯乙烷,加热480~530℃生成氯乙烯,然后发生加聚反应可生成聚氯乙烯.
解答 解:(1)分子结构为正四面体的为四氯化碳,工业上分离这些多氯代甲烷,根据物质的沸点不同,常用分馏的方法分离,
故答案为:四氯化碳;分馏;
(2)CF3CHClBr对应的同分异构体中,可根据卤素原子的位置不同判断,如F不在同一个C原子上,存在的同分异构体有CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2三种,
故答案为:CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2任意一种;
(3)乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应的方程式为H2C=CH2+Cl2→CH2ClCH2Cl,加热480~530℃生成氯乙烯,发生消去反应,
故答案为:H2C=CH2+Cl2→CH2ClCH2Cl;加成反应;消去反应.
点评 本题综合本题综合考查有机物的合成与应用,涉及有机物分离、同分异构体书写等,注意把握有机物的官能团的性质以及同分异构体的判断.

练习册系列答案
相关题目
1.下列离子方程式书写不正确的是( )
| A. | 用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O | |
| B. | 碳酸氢钠溶液中加入足量热的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| C. | 用氯酸钠的酸性溶液与H2O2作用制取ClO2:4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O | |
| D. | 用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
5.下列关于物质的量及粒子数的叙述,正确的是( )
| A. | 1 mol任何物质都含有6.02×1023个分子 | |
| B. | 0.012kg 12C中含有约6.02×1023个12C | |
| C. | 1mol CO2中含有1mol碳和2 mol氧 | |
| D. | 1mol H含有6.02×1024个质子 |
10.某化学兴趣小组利用如图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题
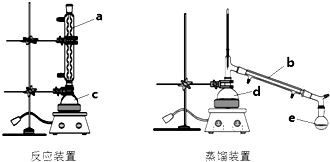
(1)写出合成乙酸乙酯的化学方程式CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
(2)仪器b的名称冷凝管,图中起冷凝回流作用的是a(填a、b、c、d、e).
(3)为了提高乙酸乙酯的产率可采取的措施将CH3COOCH2CH3及时蒸馏分离;反应温度不宜过高,减少CH3COOHCH3CH2OH的挥发;反应物控制无水条件,浓硫酸的吸水作用有利于平衡向正反应方向移动,提高产率
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有CH3CH2OH杂质.

(1)写出合成乙酸乙酯的化学方程式CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.(2)仪器b的名称冷凝管,图中起冷凝回流作用的是a(填a、b、c、d、e).
(3)为了提高乙酸乙酯的产率可采取的措施将CH3COOCH2CH3及时蒸馏分离;反应温度不宜过高,减少CH3COOHCH3CH2OH的挥发;反应物控制无水条件,浓硫酸的吸水作用有利于平衡向正反应方向移动,提高产率
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏
| 物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
| 沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
17.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是( )
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 15.7g混合物能恰好与盐酸完全反应 | |
| B. | 根据表中数据不能计算出混合物中NaHCO3的质量分数 | |
| C. | 向50ml盐酸中加入混合物27.6g时,盐酸过量 | |
| D. | 盐酸的物质的量浓度为3.0mol/L |
14.在光照条件下,将CH4和Cl2按质量比16:71混合,充分反应后得到物质的量最多的产物是( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | HCl |
15.我国“十二五”规划纲要倡导技术创新,温家宝强调稀土要可持续发展.有人发明:用一种硫酸稀土溶液离子膜可电解氧化铈(Ce2O3)成为Ce4+的溶液.使用离子交换膜将电解槽分隔为阳极室和阴极室.阳极材料是阳极液是酸性的硫酸稀土溶液.阴极液是硫酸或钠、镁、铜、镍、锰、锌等的硫酸盐溶液,或上述盐与硫酸的混和溶液.以附有Ce2O3的材料作阳极通直流电电解时,在阳极室得到含Ce4+溶液.下列有关叙述不正确的是( )
| A. | 阳极反应式为:Ce2O3-2e-+6H+═2Ce4++3H2O | |
| B. | 电解时溶液中的阳离子向阳极移动 | |
| C. | 如果阴极液是稀硫酸,电极反应式为:2H++2e-═H2↑ | |
| D. | 如果阴极液是钠、镁、铜、镍、锰、锌等的硫酸盐溶液,则在阴极室可得到铜、镍、锌、锰等金属合金粉末 |