题目内容
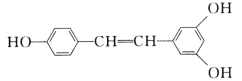
【题目】食品防腐剂R的结构简式如图所示: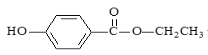 ,下列说法正确的是
,下列说法正确的是
A.R在空气中易被氧化且易溶于水
B.1个R分子最多有20个原子共平面
C.能与FeCl3发生显色反应,苯环有2个取代基,且能发生水解反应R的同分异构体有18种(包括R)
D.1molR与3molH2反应生成的有机物分子式为C9H18O3
【答案】C
【解析】
A.R结构中含有酚羟基,容易被空气中的氧气氧化,但酚和酯常温下在水中的溶解度均较小,故A错误;
B.苯环上所有原子共平面,-OH中原子共平面,酯基为平面结构,单键可以旋转,则该分子中羟基上所有原子、苯环上所有原子、酯基上所有原子、亚甲基上的碳原子和1个氢原子以及甲基上的碳原子和1个氢原子可能共平面,所以最多有19个原子共平面,故B错误;
C.能与FeCl3发生显色反应,说明含有酚羟基,苯环上含有2个取代基,且能发生水解反应R的同分异构体中还含有酯基,则另一个取代基可能为—COOCH2CH3、—CH2COOCH3、—OOCCH2CH3、—CH2OOCCH3、—CH2CH2OOCH、—CH(CH3)OOCH,每两个取代基均存在邻位、间位和对位,共18种(包括R),故C正确;
D.R的分子式为C9H10O3,只有苯环能和氢气发生加成反应,则1molR与3 molH2反应生成的有机物分子式为C9H16O3,故D错误;
故选C。

【题目】历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置_________,Ag+的价电子排布式为_________。
(2)冶金工业上,提取金的原理是2[Au(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
(3)已知基态铜的部分电离能如表所示:
电离能/kJ/mol | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是_________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到结构如图所示配合物。
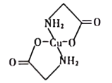
①配合物中碳原子的轨道杂化类型为_________。
②1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为_________个;该晶体的化学式为_________。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和Q原子之问的最短距离为_________pm(1pm=10-12m,只写计算式)。