题目内容
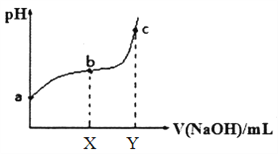
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
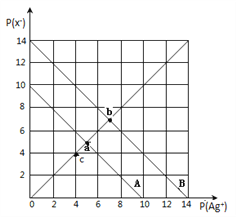
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
【答案】A
【解析】A. t℃时,c点在曲线下方,离子的浓度较大,是AgCl的过饱和溶液,A错误;B. 已知pAg=-lgc(Ag+),pX=-lgc(X-),银离子、氯离子浓度越大,浓度的负对数得到数值越小,氯化银溶解度大于溴化银,溶液中的离子浓度也是氯化银溶解度大于溴化银,所以A线表示的是AgCl,B线表示的是AgBr,B正确;C. 取a、b两点处溶液等体积混合,溶液体积增加,离子浓度减小,因此维持t℃不变,混合溶液中一定无白色沉淀生成,C正确;D. 根据图像可知银离子浓度相等时氯离子浓度是溴离子浓度的104倍,所以在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=c(Cl-)/c(Br-)≈104,D正确,答案选A。
AgBr(s)+Cl-(aq)平衡常数K=c(Cl-)/c(Br-)≈104,D正确,答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
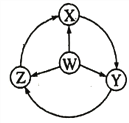
小学生10分钟应用题系列答案【题目】如图W、X、Y、Z为四种物质,若箭头是能一步转化的常见反应,其中常温下能进行的是( )
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Al | AlCl3 | NaAlO2 | Al2(SO4)3 | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Na | Na2O2 | NaOH | NaCl |
A. A B. B C. C D. D