题目内容
【题目】历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置_________,Ag+的价电子排布式为_________。
(2)冶金工业上,提取金的原理是2[Au(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
(3)已知基态铜的部分电离能如表所示:
电离能/kJ/mol | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是_________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到结构如图所示配合物。
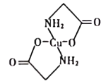
①配合物中碳原子的轨道杂化类型为_________。
②1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为_________个;该晶体的化学式为_________。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和Q原子之问的最短距离为_________pm(1pm=10-12m,只写计算式)。

【答案】第五周期IB族 4d10 CO(或N2等合理答案) 1:1 Cu+的3d电子处于全充满状态,稳定性强 sp2、sp3 8 12 CuCl 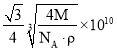
【解析】
(1)Ag的原子序数是47,位于铜的下一周期,在元素周期表中的位置是第五周期IB族,Ag+的价电子排布式为4d10。
(2)原子数和价电子数分别都相等的互为等电子体,则与CN-互为等电子体的分子有CO或N2等,HCN的结构式为H-C≡N,因此分子中σ键和π键数目之比为2:2=1:1。
(3)由于I1是失去4s电子,I2是失去3d电子,Cu+的3d电子处于全充满状态,稳定性强,因此I2(Cu)远远大于I1(Cu)。
(4)①配合物中饱和碳原子全部形成单键,为sp3杂化,酯基中的碳原子含有碳氧双键,其轨道杂化类型为sp2。
②单键都是σ键,双键中含有1个σ键,则1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为8mol。
(5)某Q原子的外围电子排布式为3s23p5,Q是Cl。铜与Cl形成化合物的晶胞如图所示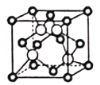 (白球代表Q原子),根据晶胞结构可知每个铜原子周围距离最近的铜原子位于面心处,其数目为12个;晶胞中含有4个Cl,Cu个数是
(白球代表Q原子),根据晶胞结构可知每个铜原子周围距离最近的铜原子位于面心处,其数目为12个;晶胞中含有4个Cl,Cu个数是![]() ,该晶体的化学式为CuCl。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体的边长是
,该晶体的化学式为CuCl。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体的边长是 cm=
cm= ×1010pm,晶胞中铜原子和Q原子之问的最短距离为体对角线的
×1010pm,晶胞中铜原子和Q原子之问的最短距离为体对角线的![]() ,即为
,即为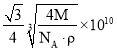 pm。
pm。

【题目】碱式碳酸铋片[主要成分(BiO)2CO3]可用于治疗慢性胃炎及缓解胃酸过多引起的胃病。由菱铋矿(主要成分为nBi2O3·mCO2·H2O,含杂质SiO2、CuS等)制备(BiO)2CO3的一种工艺如图:

试回答下列问题:
(1)为提高①的“酸溶”速率,可以采取的措施是__________(任写一种)。
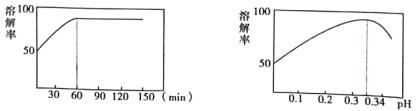
(2)①中酸溶解率与接触时间及溶液的pH之间的关系如图,据此分析,“酸溶”的最佳条件为__________;滤渣的主要成分是__________。
(3)“酸溶”后溶液必须保持强酸性,以防止铋元素流失,原理是__________。
(4)②中得到“海绵铋”的离子方程式为__________。
(5)④中反应的化学反应方程式为__________。
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Cu2+、Bi3+的混合溶液中滴加Na2S溶液,当Fe2+恰好沉淀完全时,所得溶液c(Cu2+):c(Bi3+)=__________。(忽略Na2S溶液所带来的体积变化)。
资料:①有关溶度积数据见表:
难溶物质 | FeS | CuS | Bi2S3 |
Ksp(25℃) | 6.3×10-18 | 6.3×10-36 | 1.6×10-20 |
②溶液中的离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。