题目内容
4.在强酸性溶液中可以大量共存的离子组是( )| A. | K+、NO3ˉ、HCO3ˉ、Clˉ | B. | SO42-、Mg2+、Clˉ、Na+ | ||
| C. | SO42-、Na+、Mg2+、CH3COOˉ | D. | Clˉ、AlO2ˉ、K+、NH4+ |
分析 强酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.酸溶液中不能大量存在HCO3-,故A错误;
B.酸溶液中该组离子之间不反应,可大量共存,故B正确;
C.酸溶液中不能大量存在CH3COO-,故C错误;
D.酸溶液中不能大量存在AlO2-,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
12.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D的单质中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F单质中燃烧,产物溶于水得到一种强酸.下列有关说法正确的是( )
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | B元素所形成的单质的晶体类型都是相同的 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
19.下列离子方程式的书写不正确的是( )
| A. | 氢氧化铁溶于硫酸氢钠溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | FeI2溶液中通入过量Cl2:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
9.如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).
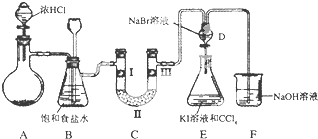
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O
①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入d;
(提示:硅胶是干燥剂,不与氯气反应)
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为Cl2+2Br-=Br2+2Cl-,若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是E中液体分为两层,下层(CCl4层)为紫红色.

(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O
①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入d;
(提示:硅胶是干燥剂,不与氯气反应)
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
16.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清的石灰水与稀盐酸反应:OH-+H+═H2O | |
| C. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
13.下列离子组能在溶液中大量共存的是( )
| A. | K+、Cu2+、NO3-、SO42- | B. | K+、H+、SO42-、OH- | ||
| C. | Al3+、NH4+、OH-、Cl- | D. | Ca2+、Na+、Cl-、CO32- |
3.对于某些离子的检验和结论正确的是( )
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有$S{O}_{4}^{2-}$ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有$C{O}_{3}^{2-}$ |