题目内容
15.下列叙述正确的是( )| A. | 甲苯能使酸性高锰酸钾溶液和溴水因发生化学反应而褪色 | |
| B. | 不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗 | |
| C. | 配制银氨时,应将大量浓氨水一次性加入到少量硝酸银溶液中 | |
| D. | 用银氨溶液或新制氢氧化铜来检验醛或酮时,均只需要水浴加热 | |
| E. | 配制氢氧化铜悬浊液时,应将少量硫酸铜溶液加入到过量的氢氧化钠溶液中 |
分析 A.甲苯与溴水不反应;
B.苯酚在水中的溶解度不大,苯酚易溶于酒精;
C.在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解得到银氨溶液;
D.用银氨溶液或新制氢氧化铜来检验醛,均与酮不反应;
E.硫酸铜与NaOH反应生成氢氧化铜,且碱过量.
解答 解:A.甲苯与溴水不反应,甲苯能被高锰酸钾氧化,故A不选;
B.苯酚在水中的溶解度不大,苯酚易溶于酒精,则不慎把苯酚溶液沾到了皮肤上,应立即用酒精擦拭,故B不选;
C.在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解得到银氨溶液,不能将浓氨水一次性加入,故C不选;
D.用银氨溶液或新制氢氧化铜来检验醛,均与酮不反应,银镜反应需要水浴加热,与氢氧化铜加热煮沸,故D不选;
E.硫酸铜与NaOH反应生成氢氧化铜,且碱过量,则可配制氢氧化铜悬浊液,故E选;
故选E.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物的性质、反应等,题目难度不大.

练习册系列答案
相关题目
5.设NA为阿佛加德罗常数的值,下列说法不正确的是( )
| A. | 常温常压下,1mol氦气含有的原子数为NA | |
| B. | 常温常压下,8g甲烷中含有的电子数为5NA | |
| C. | 22 g CO2 与标准状况下11.2 L O2含有相同分子数 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数 0.5NA |
3.下列各组离子在指定的溶液中能大量共存的是( )
| A. | 透明的溶液中:Al3+、Cu2+、SO42-、NO3- | |
| B. | 通入SO2的溶液中:Fe3+、Ba2+、Cl-、NO3- | |
| C. | 加入铝粉产生H2的溶液中:NH4+、Fe3+、SO42-、NO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol/L:K+、Ba2+、Cl-、NO3- |
10.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
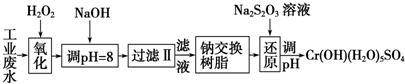
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
(1)氧化过程中可代替H2O2加入的试剂是A(填序号,下同)
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是CD
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至
10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是CD
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至
10-5 mol•L-1.
20.下列有关氧元素及其化合物表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 过氧化氢的电子式: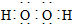 | |
| C. | 氧原子的价电子排布图: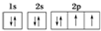 | |
| D. | 次氯酸的结构式:H-Cl-O |
6.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 锂在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为2NA | |
| D. | 常温常压下,17克NH3中含有共价键的数目为3NA |

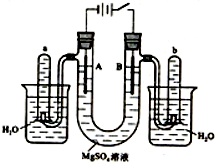 如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题:
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题: