题目内容
4.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 16g O3含有的氧原子数为NA | |
| B. | 常温常压下,22.4L SO2含有的分子数为NA | |
| C. | 1molMg变成Mg2+时,失去电子的数目为NA | |
| D. | 1L 1mol•L-1H2SO4溶液中含H+的数目为NA |
分析 A、臭氧分子由氧原子构成;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、镁变为镁离子时,失去2个电子;
D、在硫酸溶液中,除了硫酸能电离出氢离子,水也能电离出氢离子.
解答 解:A、臭氧分子由氧原子构成,故16g臭氧中含有的氧原子的物质的量为1mol,个数为NA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化硫的物质的量小于1mol,则含有的分子个数小于NA个,故B错误;
C、镁变为镁离子时,失去2个电子,故1mol镁变为1mol镁离子时失去2mol电子即2NA个,故C错误;
D、在硫酸溶液中,除了硫酸能电离出氢离子,水也能电离出氢离子,故溶液中含有的氢离子的个数大于2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
12.下列图示过程,由太阳能直接转变为化学能的是( )
| A. |  光伏发电 | B. |  风力发电 | C. |  水力发电 | D. |  光合作用 |
19.下列关于苯的说法正确的是( )
| A. | 属于高分子化合物 | |
| B. | 能与Br2的CCl4溶液发生加成反应 | |
| C. | 常温下,是密度比水小的无色液体 | |
| D. | 每个分子中含有3个碳碳单键和3个碳碳双键 |
9.已知25℃时部分弱电解质的电离平衡常数数据如表所示:
下列物质的量浓度均为0.1mol•L-1的四种溶液中pH最大的是( )
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | CH3COONa | B. | Na2CO3 | C. | NaClO | D. | NaHCO3 |
16.欲将氯化钠、沙子(主要成分为SiO2)、碘三种物质组成的混合物分离,最合理的操作顺序是( )
| A. | 溶解、过滤、加热(升华)、蒸发(结晶) | B. | 加热(升华)、溶解、过滤、蒸发(结晶) | ||
| C. | 升华、溶解、蒸馏、结晶 | D. | 溶解、结晶、过滤、升华 |
13.在恒温恒容条件下,能使反应:A(g)+B(g)?C(g)+D(g)正反应速率增大的是( )
| A. | 减小C或D的浓度 | B. | 减小B的浓度 | C. | 增大A或B的浓度 | D. | 减小A的浓度 |
14.下列物质的化学式与俗称不相符的是( )
| A. | Na2CO3-苏打 | B. | BaCO3-重金石 | C. | NH4NO3-硝铵 | D. | NaOH-火碱 |
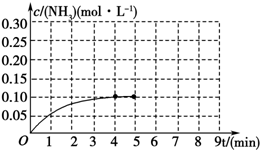 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: