题目内容
15.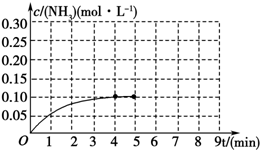 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:(1)根据如图,计算从反应开始到平衡时,平均反应速率v(NH3).
(2)该反应达到平衡时H2的转化率.
分析 (1)由图可知,4min达平衡,△c(NH3)=0.1mol/L,根据v=$\frac{△c}{△t}$计算v(NH3);
(2)利用浓度变化量之比等于化学计量数之比,根据△c(NH3)计算△c(H2),再根据n=cV计算参加反应的氢气的物质的量,据此计算转化率.
解答 解:(1)由图可知,4min达平衡,△c(NH3)=0.1mol/L,所以从反应开始到平衡时,平均反应速率为v(NH3)=$\frac{0.1mol/L}{4min}$=0.025mol/(L•min),
答:从反应开始到平衡时,平均反应速率为0.025mol/(L•min);
(2)△c(NH3)=0.1mol/L,浓度变化量之比等于化学计量数之比,所以△c(H2)=$\frac{3}{2}$△c(NH3)=$\frac{3}{2}$×0.1mol/L=0.15mol/L,故参加反应的氢气的物质的量为0.15mol/L×2L=0.3mol,
所以氢气的转化率为:$\frac{0.3mol}{0.6mol}$×100%=50%.
答:该反应达到平衡时H2的转化率为50%.
点评 本题考查了化学平衡的计算,题目难度不大,根据图象曲线变化正确判断平衡状态为解答关键,注意掌握化学反应速率、转化率的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.下列与化学反应能量变化相关的叙述不正确的是( )
| A. | 化学反应是旧键断裂和新键形成的过程 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
2.下列有关自然界中氮循环(如图)的说法不正确的是( )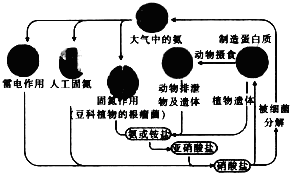

| A. | 含氮无机物和含氮有机物可相互转化 | |
| B. | 通过闪电产生NO属于高能固氮 | |
| C. | 硝酸盐被细菌分解为氮气过程氮元素一定被氧化 | |
| D. | C、H、O也参与自然界中氮循环 |
10.用NA表示阿伏加德罗常数,下列说正确是( )
| A. | 标准状况下,22.4LCC14含有的分子数为NA | |
| B. | 常温常压下,17gNH3所含的原子数目为4NA | |
| C. | 1molNa2O2与H20完全反应,转移2NA个电子 | |
| D. | O.lmol/LNa2CO3溶液中含有的Na+数目为0.2NA |
20.光亮的铁钉在下列几种情况下,最不容易生锈的是( )
| A. |  | B. |  | C. |  | D. |  |
7.我国科学家屠呦呦因发明抗疟新药青蒿素(分子式:C15H22O5)荣获2015年诺贝尔医学奖.青蒿素属于( )
| A. | 混合物 | B. | 有机物 | C. | 氧化物 | D. | 单质 |
4.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 16g O3含有的氧原子数为NA | |
| B. | 常温常压下,22.4L SO2含有的分子数为NA | |
| C. | 1molMg变成Mg2+时,失去电子的数目为NA | |
| D. | 1L 1mol•L-1H2SO4溶液中含H+的数目为NA |
5.工业上可用硫酸铝与硫黄焙烧制备氧化铝,再电解氧化铝制得铝,发生反应如下:
反应Ⅰ:2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2↑,反应Ⅱ:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑
下列说法中正确的是( )
反应Ⅰ:2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2↑,反应Ⅱ:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑
下列说法中正确的是( )
| A. | 反应Ⅰ中S单质是氧化剂 | |
| B. | 反应ⅡAl2O3中Al元素被氧化 | |
| C. | 当生成5.4 g Al时,反应Ⅰ和反应Ⅱ共转移1.2 mol e- | |
| D. | 反应Ⅰ氧化产物与还原产物物质的量之比为2:9 |

 .
.