题目内容
10.某些铁、铝制品的表面常生成一层氧化物,其主要成分分别是氧化铁、氧化铝.两种氧化物均能与盐酸反应,生成的两种盐的化学式分别为FeCl3、AlCl3.向这两种盐的溶液中分别滴加足量氢氧化钠溶液,可观察到:其中一种溶液中的现象是先产生白色沉淀,然后白色沉淀逐渐消失则该溶液为AlCl3溶液;另一种溶液中的现象是②(填序号).①产生白色沉淀
②产生红褐色沉淀
③产生白色沉淀,迅速变成灰绿色,最后变成红褐色.
分析 氧化铁和氧化铝分别和盐酸反应生成氯化铁、氯化铝和水,向氯化铝溶液中滴加足量氢氧化钠溶液,可观察到溶液中的现象是先产生白色沉淀氢氧化铝,然后白色沉淀氢氧化铝逐渐消失生成偏铝酸钠,向氯化铁溶液中滴加氢氧化钠,氢氧化钠和氯化铁溶液反应生成红褐色氢氧化铁沉淀;
解答 解:氧化铁和盐酸反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,氧化铝和盐酸反应方程式为:Al2O3+6HCl=2AlCl3+3H2O,所以二者得到的盐分别是FeCl3、AlCl3,向氯化铝溶液中滴加足量氢氧化钠溶液,可观察到溶液中的现象是先产生白色沉淀氢氧化铝,AlCl3+3NaOH=Al(OH)3↓+3NaCl,然后白色沉淀氢氧化铝逐渐消失生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,向氯化铁溶液中滴加氢氧化钠,氢氧化钠和氯化铁溶液反应,立即生成红褐色氢氧化铁沉淀,FeCl3+3NaOH=Fe(OH)3↓+3NaCl,所以看到的现象是产生红褐色沉淀,故选②,
故答案为:FeCl3;AlCl3;AlCl3;②;
点评 本题考查了氧化铁、氧化铝、铁、铝发生的化学反应,明确物质的性质是解本题关键,根据物质的性质来分析解答,注意氧化铁和盐酸反应生成氯化铁而不是氧化亚铁,注意比较氯化亚铁、氯化铁分别和氢氧化钠溶液反应现象的不同,为易错点,题目较简单.

练习册系列答案
相关题目
20.央视焦点访谈节目在2013年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图 所示,下列说法正确的是( )
所示,下列说法正确的是( )
 所示,下列说法正确的是( )
所示,下列说法正确的是( )| A. | 该有机物的分子式为C8H8O3 | |
| B. | 1 mol该有机物最多能与2 mol H2发生加成反应 | |
| C. | 该有机物能发生加成反应,取代反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能含一个羧基 |
1.下列与化学反应能量变化相关的叙述不正确的是( )
| A. | 化学反应是旧键断裂和新键形成的过程 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
18.下列各组离子在指定溶液中,能大量共存的是( )
①无色溶液中:K+、Cl-、Na+、SO42-
②使pH=11的溶液中:Na+、AlO2-、K+、CO32-
③水电离的c(H+)=10-12mo1/L的溶液中:Cl-、HCO3-、NH4+、SO32-
④加Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、SO32-
⑤酸性溶液中:Fe2+、Ag+、NO3-、I-.
①无色溶液中:K+、Cl-、Na+、SO42-
②使pH=11的溶液中:Na+、AlO2-、K+、CO32-
③水电离的c(H+)=10-12mo1/L的溶液中:Cl-、HCO3-、NH4+、SO32-
④加Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、SO32-
⑤酸性溶液中:Fe2+、Ag+、NO3-、I-.
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ①② | D. | ①②③④ |
5.以下物质间的转化不能通过一步反应实现的是( )
| A. | HClO→O2 | B. | SiO2→H2SiO3 | C. | CO2→CaCO3 | D. | Cu→CuSO4 |
2.下列有关自然界中氮循环(如图)的说法不正确的是( )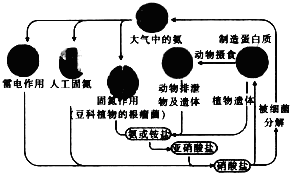

| A. | 含氮无机物和含氮有机物可相互转化 | |
| B. | 通过闪电产生NO属于高能固氮 | |
| C. | 硝酸盐被细菌分解为氮气过程氮元素一定被氧化 | |
| D. | C、H、O也参与自然界中氮循环 |
4.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 16g O3含有的氧原子数为NA | |
| B. | 常温常压下,22.4L SO2含有的分子数为NA | |
| C. | 1molMg变成Mg2+时,失去电子的数目为NA | |
| D. | 1L 1mol•L-1H2SO4溶液中含H+的数目为NA |

 .
.