题目内容
已知R元素的原子结构示意图为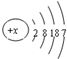 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、R元素是第4周期Ⅶ族元素 |
| B、R元素的原子在反应中易失去电子 |
| C、R元素的最高价氧化物对应水化物为HRO4 |
| D、R元素的气态氢化物比同主族的上一周期元素的气态氢化物稳定性强 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、根据原子序数判断元素在周期表中位置;
B、根据最外层电子数判断得失电子能力;
C、根据最外层电子判断最高化合价,再确定最高价氧化物对应水化物;
D、根据元素周期律判断;
B、根据最外层电子数判断得失电子能力;
C、根据最外层电子判断最高化合价,再确定最高价氧化物对应水化物;
D、根据元素周期律判断;
解答:
解:A、R元素的原子结构示意图为 ,所以R为35号,溴元素,在周期表中第ⅦA族,故A错误;
,所以R为35号,溴元素,在周期表中第ⅦA族,故A错误;
B、溴原子最外层有7个电子,容易得到电子,故B错误;
C、溴原子最外层有7个电子,所以它的最高化合价为+7价,对应的最高价氧化物对应水化物为HBrO4,故C正确;
D、根据元素周期律,同主族元素从上向下,对应的氢化物的稳定性减弱,故D错误;
故选C.
 ,所以R为35号,溴元素,在周期表中第ⅦA族,故A错误;
,所以R为35号,溴元素,在周期表中第ⅦA族,故A错误;B、溴原子最外层有7个电子,容易得到电子,故B错误;
C、溴原子最外层有7个电子,所以它的最高化合价为+7价,对应的最高价氧化物对应水化物为HBrO4,故C正确;
D、根据元素周期律,同主族元素从上向下,对应的氢化物的稳定性减弱,故D错误;
故选C.
点评:本题主要考查了原子结构与元素性质的关系,难度不大,解题时注意仔细审题,A选项为易错点.

练习册系列答案
相关题目
已知H2(g)+Cl2(g)=2HCl(g)△H=-92.3kJ?mol-1,则反应2HCl(g)=H2(g)+Cl2(g)的△H为( )
| A、+184.6kJ?mol-1 |
| B、-92.3kJ?mol-1 |
| C、-369.2kJ?mol-1 |
| D、+92.3kJ?mol- |
取一定量的NH4NO3和(NH4)2SO4固体混合物,分成质量相等的两等份.一份与足量的NaOH浓溶液共热,在标准状况下收集到6.72L NH3;另一份加水完全溶解后,加入过量的BaCl2溶液得到11.65g白色沉淀.下列说法错误的是( )
| A、原固体混合中n[(NH4)2SO4]=0.05 mol |
| B、原固体混合中m(NH4NO3)=16 g |
| C、若完全溶解后溶液的体积为100 mL,则c(NH4NO3)=4 mol?L-1 |
| D、原固体混合中n(NH4NO3):n[(NH4)2SO4]=4:1 |
X、Y、W、R、T是前17号元素中的5种,X、Y位于同主族,Y原子的最外层电子数与次外层电子数相等,R原子的最外层电子数为次外层电子数的3倍,T无正价,W单质用于制造计算机芯片,下列说法不正确的是( )
| A、气态氢化物稳定性:W<T |
| B、离子半径:X<R |
| C、最高价氧化物对应水化物碱性:X>Y |
| D、Y单质能与冷水剧烈反应 |