题目内容
重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO?Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如图:
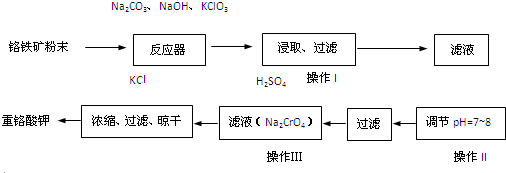
(1)铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式: .
(2)反应器中发生的主要反应为:
6FeO?Cr2O3+24NaOH+7KClO3
12Na2CrO4+3Fe2O3+7KCl+12H2O.
Fe2O3可进一步转化为NaFeO2.NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式: .
(3)操作Ⅱ的目的是 .
(4)操作Ⅲ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式: .
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol?L-1 H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol?L-1 Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-═2I-+S4O62-).
①写出重铬酸钾与碘化钾反应的离子方程式: ;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为 .

(1)铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:
(2)反应器中发生的主要反应为:
6FeO?Cr2O3+24NaOH+7KClO3
| ||
Fe2O3可进一步转化为NaFeO2.NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:
(3)操作Ⅱ的目的是
(4)操作Ⅲ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol?L-1 H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol?L-1 Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-═2I-+S4O62-).
①写出重铬酸钾与碘化钾反应的离子方程式:
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为
考点:制备实验方案的设计
专题:实验设计题
分析:流程分析可知,铬铁矿(主要成分为FeO?Cr2O3,杂质为SiO2、Al2O3)为原料粉碎后再反应器中加入纯碱、固体氢氧化钠、氯酸钾浸取过滤得到滤液调节溶液PH除去铝和硅酸根离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾;
(1)高温条件下,氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳;
(2)NaFeO2能强烈水解,生成氢氧化铁沉淀;
(3)调节后溶液的pH比原来降低,是因降低pH,促进水解平衡正向移动;
(4)CrO42-和酸反应生成Cr2O72-和水;
(5)①重铬酸钾具有强氧化性能把碘离子氧化成单质碘,本身被还原为三价铬离子,据此析出反应的离子方程式;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,存在Cr2O72-~6S2O32-,以此计算.
(1)高温条件下,氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳;
(2)NaFeO2能强烈水解,生成氢氧化铁沉淀;
(3)调节后溶液的pH比原来降低,是因降低pH,促进水解平衡正向移动;
(4)CrO42-和酸反应生成Cr2O72-和水;
(5)①重铬酸钾具有强氧化性能把碘离子氧化成单质碘,本身被还原为三价铬离子,据此析出反应的离子方程式;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,存在Cr2O72-~6S2O32-,以此计算.
解答:
解:(1)高温条件下,氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳,反应方程式为:Al2O3+Na2CO3
2NaAlO2+CO2↑,
故答案为:Al2O3+Na2CO3
2NaAlO2+CO2↑;
(2)NaFeO2能强烈水解,生成氢氧化铁沉淀,该水解反应为NaFeO2+2H2O=Fe(OH)3↓+NaOH,
故答案为:NaFeO2+2H2O=Fe(OH)3↓+NaOH;
(3)调节后溶液的pH比原来降低,是由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:除去SiO32-和AlO2-;
(4)CrO42-和酸反应生成Cr2O72-和水,转化方程式为:2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(5)①重铬酸钾具有强氧化性能把碘离子氧化成单质碘,本身被还原为三价铬离子,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,故答案为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在Cr2O72-~6S2O32-,
1 6
n 0.1200×40×10-3mol
则250ml含重铬酸钾的物质的量为n=
×10,则所得产品中重铬酸钾纯度为
×100%=94.08%,
故答案为:94.08%.
| ||
故答案为:Al2O3+Na2CO3
| ||
(2)NaFeO2能强烈水解,生成氢氧化铁沉淀,该水解反应为NaFeO2+2H2O=Fe(OH)3↓+NaOH,
故答案为:NaFeO2+2H2O=Fe(OH)3↓+NaOH;
(3)调节后溶液的pH比原来降低,是由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:除去SiO32-和AlO2-;
(4)CrO42-和酸反应生成Cr2O72-和水,转化方程式为:2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(5)①重铬酸钾具有强氧化性能把碘离子氧化成单质碘,本身被还原为三价铬离子,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,故答案为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在Cr2O72-~6S2O32-,
1 6
n 0.1200×40×10-3mol
则250ml含重铬酸钾的物质的量为n=
| 0.1200×40×10-3mol |
| 6 |
| 0.1200×40×10-3×10×294 |
| 6×2.5000 |
故答案为:94.08%.
点评:本题考查混合物的分离、提纯,明确流程中操作的目的是解答的关键,注意利用关系式计算,(5)为解答的难点,题目难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
已知R元素的原子结构示意图为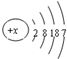 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、R元素是第4周期Ⅶ族元素 |
| B、R元素的原子在反应中易失去电子 |
| C、R元素的最高价氧化物对应水化物为HRO4 |
| D、R元素的气态氢化物比同主族的上一周期元素的气态氢化物稳定性强 |
已知3.2g某气体的分子数目为3.01×1022,由此可推知该气体的摩尔质量是( )
| A、64 g |
| B、32 g?mol-1 |
| C、32 g |
| D、64 g?mol-1 |
下列基本实验操作中,不合理的是( )
| A、配制一定物质的量浓度溶液,向容量瓶加水至离刻度线1~2cm时,改用胶头滴管定容 |
| B、可用湿润的pH试纸检验氨气 |
| C、用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子,不含有钠离子 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
向混浊的水中加入明矾〔K Al (SO4)2?12H2O〕后,水可得到净化,其中起到净化作用的是( )
| A、k+ |
| B、Al3+ |
| C、SO42- |
| D、明矾溶于水后产生的氢氧化铝胶体 |
