题目内容
15. H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列说法正确的是( )
H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列说法正确的是( )| A. | 过程 1 放热 | B. | 过程 2 吸热 | C. | 过程 3 放热 | D. | 过程 4 放热 |
分析 断裂化学键吸收能量、形成化学键释放能量,且焓变为吸收能量减去释放的能量,互为逆反应时焓变的数值相同、符号相反,以此来解答.
解答 解:A.过程1断裂化学键,吸收热量,故A错误;
B.过程2形成化学键,释放热量,故C错误;
C.燃烧反应为放热反应,则过程 3 放热,故C正确;
D.过程4为HCl分解生成H2和Cl2,吸收热量,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意过程3、4的关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.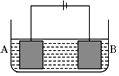 按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
 按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )| A. | 4:1 | B. | 3:1 | C. | 2:1 | D. | 1:1 |
10.某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-).将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验.下列说法正确的是( )
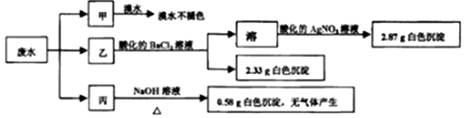

| A. | 废水可能含有Na+、K+、Fe3+ | |
| B. | 可能存在的离子用焰色反应进一步检验确认 | |
| C. | 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol•L-1 | |
| D. | 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+ |
20. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )| A. | 非金属性:X<T<Z | B. | 第一电离能:X<T<Z | ||
| C. | 气态氢化物的还原性:X<T<R | D. | 最高价氧化物的水化物酸性:Q<T<R |
7.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
现在体积为1L的密闭容器中,充入CO2和H2.实验测得反应体系中物质的物质的量与时间关系如下表,
回答下列问题:
(1)表格中的n1=0.75mol
(2)0-5min内 v (H2)=0.3mol•L-1•min-1
(3)该条件下CO2的平衡转化率为75%.
现在体积为1L的密闭容器中,充入CO2和H2.实验测得反应体系中物质的物质的量与时间关系如下表,
| n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
| 0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
| 5min | 0.50mol | 0.50mol | ||
| 10min | 0.25mol | 0.75mol | ||
| 15min | 0.25mol | n1 |
(1)表格中的n1=0.75mol
(2)0-5min内 v (H2)=0.3mol•L-1•min-1
(3)该条件下CO2的平衡转化率为75%.
4.有机物R的结构简式如图所示.下列有关R的性质叙述正确的是( )
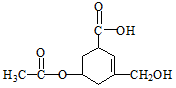

| A. | R的所有原子一定在同一平面上 | |
| B. | 在Ni催化和加热条件下,lmolR能与3molH2发生加成反应 | |
| C. | R既能与羧酸、醇反应,还能发生水解、加成和氧化反应 | |
| D. | 1molR与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol |
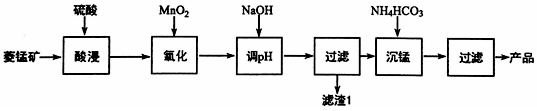
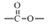 结构
结构  .
.