题目内容
1.一定条件下将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温高压}$2NH3.下列关于该反应的说法正确的是( )| A. | 最终可生成0.2 mol NH3 | |
| B. | 增大压强能使反应速率减小 | |
| C. | 降低反应体系的温度能加快反应速率 | |
| D. | 向容器中再加入N2,能加快反应速率 |
分析 A、反应是可逆反应不能进行彻底;
B、增大压强反应速率增大,正逆反应速率都增大;
C、降温,正逆反应速率都减小;
D、向容器中再加入N2,增大反应物浓度,能加快反应速.
解答 解:A、反应是可逆反应不能进行彻底,将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2?2NH3.生成的氨气物质的量一定小于0.2mol,故A错误;
B、增大压强反应速率增大,正逆反应速率都增大,故B错误;
C、降温,正逆反应速率都减小,故C错误;
D、向容器中再加入N2,增大反应物浓度,能加快反应速,故D正确.
故选D.
点评 本题考查了化学平衡影响因素分析,掌握原理应用是关键,题目较简单.

练习册系列答案
相关题目
11.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
| A. | 镁片作为负极 | B. | 正极发生氧化反应 | ||
| C. | 电池工作时镁片逐渐被消耗 | D. | 食盐水作为电解质溶液 |
12.某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、铝粉、钠、新制的Na2S溶液,新制的氯水,0.5mol/L的盐酸,3mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:
请回答下列问题:
(1)实验③的现象是生成淡黄色沉淀,该反应的离子方程式为S2-+Cl2=2Cl-+S↓.
(2)由实验③得出的实验结论是氯原子的得电子能力比硫原子强.
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确并说明原因否;浓度、接触面积等外界因素也影响着化学反应速率.
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
(1)实验③的现象是生成淡黄色沉淀,该反应的离子方程式为S2-+Cl2=2Cl-+S↓.
(2)由实验③得出的实验结论是氯原子的得电子能力比硫原子强.
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确并说明原因否;浓度、接触面积等外界因素也影响着化学反应速率.
9.某有机物A在酸性溶液中加热可发生如下反应,下列说法错误的是( )
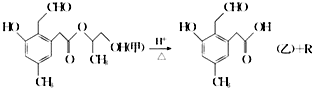

| A. | R为二元醇,不能发生银镜反应 | |
| B. | 1 mol甲在一定条件下与氢气反应,最多可消耗 5mol H2 | |
| C. | 甲在碱性条件下也可发生水解反应 | |
| D. | 甲和乙均能发生银镜反应 |
6.科学家预测原子序数为114的元素,具有相当稳定性的同位素,称为类铅.关于它的性质,预测错误的是( )
| A. | 它的最外层电子数为4 | B. | 它的金属性比铅强 | ||
| C. | 它的最高价氧化物的水化物是强酸 | D. | 它的位置在第7周期IVA族 |
13. “即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
 “即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )| A. | 氢氧化钡晶体和氯化铵晶体 | B. | 生石灰与水 | ||
| C. | 金属钠与水 | D. | 氯化钠与水 |
10.为探究溴乙烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙两位同学分别设计如下实验方案:
甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应.
乙:向反应混合液中滴入硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成,则可证明发生了消去反应.
则有关上述实验方案的叙述正确的是( )
甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应.
乙:向反应混合液中滴入硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成,则可证明发生了消去反应.
则有关上述实验方案的叙述正确的是( )
| A. | 甲正确 | B. | 乙正确 | C. | 甲、乙均正确 | D. | 甲、乙均不正确 |
11.下列有关化学用语表示正确的是( )
| A. | 次氯酸的电子式 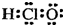 | |
| B. | S2-的结构示意图: | |
| C. | 质子数为92,中子数为143的铀原子:23592U | |
| D. | NH4I的电子式: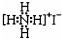 |
 黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸: