题目内容
5.下列分子或离子中,中心原子含有孤对电子的是( )| A. | NH4+ | B. | CCl4 | C. | SiH4 | D. | PH3 |
分析 分子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数-配原子个数×配原子形成稳定结构需要的电子数),阳离子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数-电荷数-配原子个数×配原子形成稳定结构需要的电子数),阴离子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数+电荷数-配原子个数×配原子形成稳定结构需要的电子数),以此解答.
解答 解:A.铵根离子中中心原子氮原子孤电子对个数=$\frac{1}{2}$(5-1-4×1)=0,没有孤对电子,故A不选;
B.CCl4中心原子碳原子孤电子对个数=$\frac{1}{2}$(4-4×1)=0,没有孤对电子,故B不选;
C.SiH4中中心原子硅原子孤电子对个数=$\frac{1}{2}$(4-4×1)=0,没有孤对电子,故C不选;
D.PH3中中中心原子磷原子孤电子对个数=$\frac{1}{2}$(5-3×1)=1,故D选.
故选D.
点评 本题考查了化合物中孤电子对个数的计算方法,根据价层电子对互斥理论计算即可,注意其阴阳离子孤电子对个数的计算方法,为易错点,该考点常常与分子的空间构型、原子的杂化方式联合考查,题目难度不大.

练习册系列答案
相关题目
15.磷酸铁锂电池是一种新型锂电池,该电池的总反应式为Li+FePO4═LiFePO4.该电池所用的磷酸亚铁锂可按如下方法生产:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中灼烧即得晶态磷酸亚铁锂,下列有关说法错误的是( )
| A. | 在电解制备磷酸亚铁锂的过程中,阳极的电极反应式为:Fe+H2PO4-+Li+-2e-═LiFePO4+2H+ | |
| B. | 放电过程中Li+向负极移动,充电过程中Li+向阴极移动 | |
| C. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| D. | 该锂电池放电时正极反应式为FePO4+Li++e-═LiFePO4 |
16. 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol Br 2 的浓溴水反应 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
13.下列变化属于取代反应的是( )
| A. | CH≡CH+HCl→CH2=CHCl | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. |  | D. |  |
20.下表为六种短周期元素的部分性质,下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Y2-的半径要小于R- | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
10.某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品,经了解其来源并查阅相关资料(如下表),初步确认为铜制品.
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究.
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是青铜表面长出了铜绿(只写一个).
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆.其判断依据是油漆是有机物,可燃.
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧.将表面刮净后的铜制品也投入盐酸中,并无气体产生.由此证明该铜制品不是青铜,理由是青铜中含有金属锡,能与盐酸反应生成氢气.
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[Cu2(OH)2CO3].于是按如图所示装置进行实验.

实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了白色固体变蓝色的现象,C中观察到了澄清石灰水变浑浊的现象.
B中所发生反应的化学方程式为:CuSO4+5H2O=CuSO4•5H2O.
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是无法确定分解产物中是否有水.
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:Cu2(OH)2CO3+8NH3•H2O=2Cu(NH3)42++2OH-+CO32-+8H2O.
| 紫铜 | 青铜 | 铜绿 | |
| 主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
| 性质与用途 | 紫红色,质软,导电性能良好;主要用作电线电缆. | 多呈灰绿色,熔点低、硬度大、可塑性强;可铸造成各种器具. | 不溶于水的灰绿色粉末,溶于酸,加热易分解;可作颜料、杀虫剂. |
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是青铜表面长出了铜绿(只写一个).
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆.其判断依据是油漆是有机物,可燃.
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧.将表面刮净后的铜制品也投入盐酸中,并无气体产生.由此证明该铜制品不是青铜,理由是青铜中含有金属锡,能与盐酸反应生成氢气.
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[Cu2(OH)2CO3].于是按如图所示装置进行实验.

实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了白色固体变蓝色的现象,C中观察到了澄清石灰水变浑浊的现象.
B中所发生反应的化学方程式为:CuSO4+5H2O=CuSO4•5H2O.
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是无法确定分解产物中是否有水.
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:Cu2(OH)2CO3+8NH3•H2O=2Cu(NH3)42++2OH-+CO32-+8H2O.
17.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式为: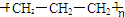 | B. | 丙烷分子的比例模型为: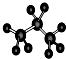 | ||
| C. | 羟基的电子式: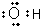 | D. | 2-乙基-1,3-丁二烯分子的键线式: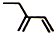 |
14.下列说法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 | |
| B. | 可逆反应达到平衡,反应就不再进行 | |
| C. | 加入催化剂加快了反应速率,改变了反应吸收或放出的热量 | |
| D. | 同温、同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
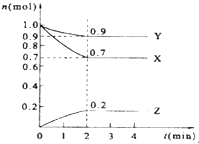 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.