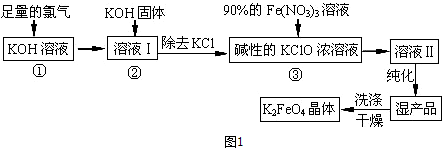
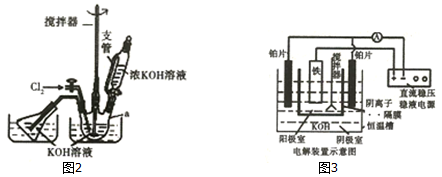
题目内容
17.已知X为ⅠA族金属元素,Y为ⅦA族元素,则X与Y形成的化合物中相邻原子间存在的相互作用是( )| A. | 离子键 | B. | 极性共价键 | C. | 非极性共价键 | D. | 范德华力 |
分析 X为ⅠA族元素,Y为ⅦA族元素,X为碱金属,与Y形成离子键,以此来解答.
解答 解:X为碱金属元素,属于活泼金属元素,Y为第VIIA族元素,属于活泼非金属元素,二者易通过得失电子形成离子键,故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及IA族元素为解答的关键,侧重分析与应用能力的考查,注意X为ⅠA族金属元素为易错点,答题时注意审题,题目难度不大.

练习册系列答案
相关题目
5.下列物质中含有共价键的离子化合物是( )
| A. | CaCl2 | B. | NH4HCO3 | C. | Na2O | D. | H2O2 |
12.a、b、c、d为四种短周期元素,a的原子M电子层有l个电子,b是地壳中含量最多的金属元素,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.关于这四种元素下列叙述错误的是( )
| A. | a、c、d均存在两种以上的氧化物 | |
| B. | b的氧化物与d的最高价氧化物对应水化物反应后的溶液呈酸性 | |
| C. | a是短周期中金属性最强的元素 | |
| D. | 工业上是通过电解b、d形成的化合物制取b单质 |
2.下列说法正确的是( )
| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)>$\sqrt{{K}_{w}}$ | |
| B. | 常温下,向10mL pH=3的CH3COOH溶液中加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| C. | Ksp不仅与难容电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 常温下,浓度相同的①CH3COONa溶液、②NaClO溶液、③NaCl溶液中的c(H+):②>①>③ |
6.下列实验操作和现象与所得结论一定正确的是( )
| 选项 | 操作 | 现象 | 结论或解释 |
| A | 向黄色的Fe(NO)3溶液中滴加氢碘酸,再加入一定量CCl4振荡并静置 | 下层溶液变为紫红色 | 氧化性:Fe3+>I2 |
| B | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中一定大量存在SO32- |
| C | 向Mg2+和Cu2+共存的溶液中滴加适量 NaOH溶液,过滤、洗涤 | 得到白色沉淀 | 相同温度下,溶度积常数: Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
| D | 一定温度下,向K2Cr2O7溶液中加入少量KOH溶液 | 溶液橙色变浅 | 减小H+浓度,Cr2O72-+H2O?2CrO42-+2H+的平衡正向移动 |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法正确的是( )
| A. | 人体必需的营养素有五种,分别为:糖类、油脂、蛋白质、维生素、矿物质(无机盐) | |
| B. | 缺钙会引起骨质疏松,可通过饮用 Ca2+含量高的硬水来补充 | |
| C. | 青少年正处在长身体时期,所以应多吃米饭和肉,少吃蔬菜水果 | |
| D. | 每一种食物含有多种营养素,每种营养素又存在于多种食物中,因此对营养素的摄取应综合考虑 |

 ; B、C、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答) A、B气态氢化物沸点更高的是H2O;
; B、C、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答) A、B气态氢化物沸点更高的是H2O;