题目内容
2.下列说法正确的是( )| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)>$\sqrt{{K}_{w}}$ | |
| B. | 常温下,向10mL pH=3的CH3COOH溶液中加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| C. | Ksp不仅与难容电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 常温下,浓度相同的①CH3COONa溶液、②NaClO溶液、③NaCl溶液中的c(H+):②>①>③ |
分析 A.纯水中c(H+)=c(OH-)=$\sqrt{{K}_{w}}$,稀硝酸电离出的氢离子抑制了水的电离;
B.根据醋酸根离子的水解平衡常数分析;
C.难溶物溶度积与溶液中离子浓度大小无关;
D.醋酸钠、次氯酸钠溶液呈碱性,氯化钠溶液呈中性,则NaCl溶液中氢离子浓度最大,然后结合盐的水解程度分析.
解答 解:A.0.1mol•L-1的HNO3溶液中,氢离子抑制了水的电离,则水电离出的c(H+)<$\sqrt{{K}_{w}}$,故A错误;
B.CH3COO-的水解平衡常数为KH,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$=$\frac{1}{{K}_{H}}$,稀释过程中醋酸根离子的水解平衡常数不变,则溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变,故B正确;
C.Ksp与难容电解质的性质和温度有关,但与溶液中相关离子的浓度无关,故C错误;
D.常温下,浓度相同的①CH3COONa溶液、②NaClO溶液、③NaCl溶液中,①②溶液呈碱性、③呈中性,则③溶液中c(H+)最大;由于HClO的酸性较弱,则NaClO溶液的碱性较强,其溶液中c(H+)较小,所以三种溶液中c(H+)大小为:③>①>②,故D错误;
故选B.
点评 本题考查较为综合,涉及难溶物溶解平衡及其影响、盐的水解原理、水的电离及其影响等知识,注意掌握盐的水解原理及其影响因素,B为易错点,可利用醋酸根离子的水解平衡常数分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.有些物质既能与盐酸反应又能与 NaOH 反应,不符合这一性质的是( )
| A. | Al | B. | Al2O3 | C. | Al(OH)3 | D. | AlCl3 |
13.下列一些诗句、成语、谚语等包含吸热反应过程的是( )
①野火烧不尽,春风吹又生;
②春蚕到死丝方尽,蜡炬成灰泪始干;
③千锤万凿出深山,烈火焚烧若等闲;
④爆竹声中一岁除,春风送暖入屠苏;
⑤只要功夫深,铁杵磨成针;
⑥火树银花;
⑦死灰复燃;
⑧凿壁偷光.
①野火烧不尽,春风吹又生;
②春蚕到死丝方尽,蜡炬成灰泪始干;
③千锤万凿出深山,烈火焚烧若等闲;
④爆竹声中一岁除,春风送暖入屠苏;
⑤只要功夫深,铁杵磨成针;
⑥火树银花;
⑦死灰复燃;
⑧凿壁偷光.
| A. | ②③⑤ | B. | ③④⑤ | C. | ⑤⑦⑧ | D. | 只有③ |
10.能用键能知识加以解释的是( )
| A. | 稀有气体的化学性质很不活泼 | B. | HF气体比HCl气体沸点高 | ||
| C. | 干冰易升华 | D. | 氮气的化学性质很稳定 |
17.已知X为ⅠA族金属元素,Y为ⅦA族元素,则X与Y形成的化合物中相邻原子间存在的相互作用是( )
| A. | 离子键 | B. | 极性共价键 | C. | 非极性共价键 | D. | 范德华力 |
7.BaCl2常用作分析试剂,也常直接用于制造钡盐以及电子、仪表、冶金等工业.我国目前比较成熟的生产BaCl2•xH2O的工艺是以重晶石(主要成分BaSO4,杂质为Fe2O3)、无烟煤粉和盐酸为原料生产,流程如图所示(部分产物已略去).

(1)写出BaCl2的电子式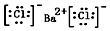 .
.
(2)“还原焙烧”时,使过量的无烟煤粉和重晶石粉混合物在高温下发生反应,该反应的化学方程式为BaSO4+4C$\frac{\underline{\;焙烧\;}}{\;}$BaS+4CO↑.
(3)“盐酸浸”得到的是氯化钡粗液,其中残余的含硫化合物会影响产品质量,必须通过鼓入热空气吹除.鼓入热空气能有效去杂的原理是升高温度可降低H2S的溶解度,利于吹出;升高温度,利于使H2S氧化成S沉淀除去.
(4)生产过程中所产生的尾气含有毒性较高的H2S,为防止环境污染,必须进行吸收处理,下列不可行的吸收液是BC.
A.CuSO4溶液B.浓硫酸C.NaHS溶液D.氨水
(5)随着工艺条件的不同,产品BaCl2•xH2O中的x数值有所不同.产品检验部门通常采用的操作是:Ⅰ称取样品a g;Ⅱ充分加热;Ⅲ置于干燥器中冷却;Ⅳ称量质量为b g.由此可得出x=$\frac{208(a-b)}{18b}$(请写出计算表达式).
(6)工业检测MgCl2•xH2O中的x值时不用以上加热法,而多采用沉淀滴定法,其原因是(用化学方程式表示)MgCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl+(x-1)H2O.沉淀滴定的测定步骤为:称取0.5000g待测产品,用适量硝酸溶解,滴加指示剂,用AgNO3标准溶液滴定.
根据上表数据分析,该滴定可选用Na2CrO4作指示剂.使用该指示剂时,判断滴定达到终点的现象是当滴入最后一滴AgNO3溶液出现砖红色沉淀,放置30s砖红色不消失.

(1)写出BaCl2的电子式
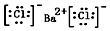 .
.(2)“还原焙烧”时,使过量的无烟煤粉和重晶石粉混合物在高温下发生反应,该反应的化学方程式为BaSO4+4C$\frac{\underline{\;焙烧\;}}{\;}$BaS+4CO↑.
(3)“盐酸浸”得到的是氯化钡粗液,其中残余的含硫化合物会影响产品质量,必须通过鼓入热空气吹除.鼓入热空气能有效去杂的原理是升高温度可降低H2S的溶解度,利于吹出;升高温度,利于使H2S氧化成S沉淀除去.
(4)生产过程中所产生的尾气含有毒性较高的H2S,为防止环境污染,必须进行吸收处理,下列不可行的吸收液是BC.
A.CuSO4溶液B.浓硫酸C.NaHS溶液D.氨水
(5)随着工艺条件的不同,产品BaCl2•xH2O中的x数值有所不同.产品检验部门通常采用的操作是:Ⅰ称取样品a g;Ⅱ充分加热;Ⅲ置于干燥器中冷却;Ⅳ称量质量为b g.由此可得出x=$\frac{208(a-b)}{18b}$(请写出计算表达式).
(6)工业检测MgCl2•xH2O中的x值时不用以上加热法,而多采用沉淀滴定法,其原因是(用化学方程式表示)MgCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl+(x-1)H2O.沉淀滴定的测定步骤为:称取0.5000g待测产品,用适量硝酸溶解,滴加指示剂,用AgNO3标准溶液滴定.
| AgCl | AgI | Ag2CrO4 | |
| Ksp | 2×10-10 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 黄 | 砖红 |
14.已知有机物A的红外光谱和核磁共振氢谱如图,下列说法错误的是( )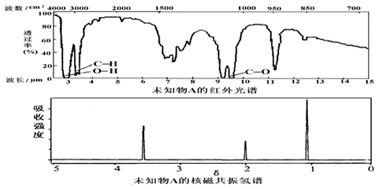

| A. | 由红光外谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 | |
| C. | 若A的化学式为C3H6O,则其结构简式为CH3COCH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
11. 构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )
构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )
 构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )
构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )| A. | 一段时间后电流计指针将归零,此时可视为反应不再进行 | |
| B. | 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升 | |
| C. | 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加 | |
| D. | 实验开始先闭合K2,断开K1,此时NO3-向B电极移动 |
12.以下有关有机物的应用或说法正确的是( )
| A. | 葡萄糖、蔗糖均可发生银镜反应 | |
| B. | 硫酸铵和乙酸铅均能使蛋白质发生变性 | |
| C. | 乙炔和乙醛均可合成聚合物 | |
| D. | 淀粉和油脂都是能发生水解反应的高分子化合物 |