题目内容
12.下列离子方程式书写正确的是( )| A. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| B. | 氧化钠投入水中发生反应:O2-+H2O═2OH- | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| D. | 金属铁溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
分析 A.二氧化碳足量反应生成碳酸氢钙;
B.氧化钠不能拆;
C.电荷不守恒;
D.不符合反应客观事实.
解答 解:A.向澄清石灰水中通入足量二氧化碳,离子方程式:OH-+CO2═HCO3-,故A正确;
B.氧化钠投入水中发生反应,离子方程式:Na2O+H2O═2Na++2OH-,故B错误;
C.硝酸银溶液中加入铜粉,离子方程式:2Ag++Cu═Cu2++2Ag,故C错误;
D.金属铁溶于稀硫酸中,离子方程式:Fe+2H+═Fe2++H2↑,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意氧化物应保留化学式拆分,题目难度不大.

练习册系列答案
相关题目
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | ag C2H4和C3H6的混合物所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子数大于0.6NA |
20.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸试剂的物质的量浓度为18.4 | |
| B. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L |
7.下列过程中,涉及化学变化的是( )
| A. | 粗盐提纯 | B. | 蒸馏法将海水淡化为饮用水 | ||
| C. | 活性炭使红墨水褪色 | D. | 四氯化碳萃取碘水中的碘 |
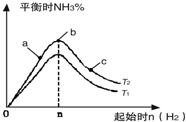
17.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,相关数据如下定条件下,在体积为1L的密闭容器中加入1mol N2和3mol H2充分反应,放出热量Q1kJ,下列说法正确的是( )
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
| A. | 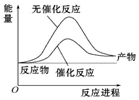 如图可表示合成氨过程中的能量变化 | |
| B. | a的数值为391 | |
| C. | Q1的数值为92 | |
| D. | 相同条件下,反应物若为2 mol N2和6 mol H2,放出热量Q2>2Q1 |
1.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
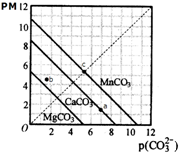

| A. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | |
| B. | b点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) | |
| C. | c可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) | |
| D. | MgCO3、CaCO3、MnCO3的Ksp依次增大 |
19.在T℃条件下,向1L固定体积的密闭容器M中加入2mol X和1mol Y,发生如下反应:2X(g)+Y(g)?a Z(g)+W(g)△H=-Q kJ•mol-1(Q>0,a为正整数).
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为1.
(2)下列说法中能说明该反应达到了化学平衡状态的是AC.
A.容器内压强一定 B.容器内气体的密度一定C.容器内Z分子数一定 D.容器内气体的质量一定
(3)温度维持T℃不变,若起始时向容器M中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是A (稀有气体不参与反应).
A.2mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1mol X、0.5mol Y、0.5a mol Z、0.5mol W D.2mol X、1mol Y、1mol Z
(4)温度维持T℃不变,若起始时向容器M中加入4mol X和6mol Y,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为QkJ.
(5)温度维持T℃不变,若在一个和原容器体积相等的恒压容器N 中,加入2mol X和1mol Y发生如上反应并达平衡,则N(选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M>N(选填>、<、=符号).
(6)已知:该反应的平衡常数随温度的变化如下表:
若在某温度下,2mol X和1mol Y在容器M中反应达平衡,X的平衡转化率为50%,则该温度为350℃.
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为1.
(2)下列说法中能说明该反应达到了化学平衡状态的是AC.
A.容器内压强一定 B.容器内气体的密度一定C.容器内Z分子数一定 D.容器内气体的质量一定
(3)温度维持T℃不变,若起始时向容器M中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是A (稀有气体不参与反应).
A.2mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1mol X、0.5mol Y、0.5a mol Z、0.5mol W D.2mol X、1mol Y、1mol Z
(4)温度维持T℃不变,若起始时向容器M中加入4mol X和6mol Y,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为QkJ.
(5)温度维持T℃不变,若在一个和原容器体积相等的恒压容器N 中,加入2mol X和1mol Y发生如上反应并达平衡,则N(选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M>N(选填>、<、=符号).
(6)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
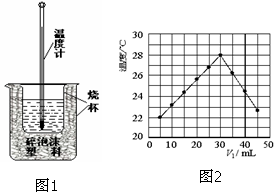 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: