题目内容
12.锌是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池的制造有不可磨灭的贡献.Ⅰ.湿法炼锌某种冶炼过程可用右图表示:
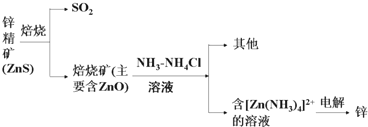
(1)电解过程中析出锌一极的电极反应式为:[Zn(NH3)4]2++2e-═Zn+4NH3↑;
(2)ZnO像Al2O3一样,属于两性氧化物,则ZnO与NaOH溶液反应的离子方程式为:ZnO+2OH-+H2O═[Zn(OH)4]2-(“锌酸”的化学式可写成H2[Zn(OH)4]).
Ⅱ.锌电池 用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空气电池等.
(1)锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O═2MnO(OH)+Zn(OH)2,正极反应式为:2MnO2+2H2O+2e-═2MnO(OH)+2OH-.
(2)新型锌空气电池与锂电池相比,其储量是它的三倍,成本是锂电池的一般,并且完全没有过热爆炸的安全隐患.该电池的总反应为:2Zn+O2═2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为:Zn-2e-+2OH-═ZnO+H2O.若以该电池为电源,用惰性电极电解AgNO3溶液,为保证阴极有10.8g银析出,至少需要2.8L空气(折算成标准状况)进入该电池(空气中氧气的体积分数为$\frac{1}{5}$).
分析 Ⅰ.含锌矿的主要成分是ZnS,焙烧与空气中氧气发生氧化还原反应,2ZnS+3O2$\frac{\underline{\;焙烧\;}}{\;}$2SO2+2ZnO,氧化锌像氧化铝一样,属于两性氧化物,加入NH3、NH4Cl溶液,得到[Zn(NH3)4]Cl2溶液,电解阳极氯离子放电,阴极[Zn(NH3)4]2++2e-═Zn+4NH3↑,氧化锌与氢氧化钠反应ZnO+2OH-+H2O═[Zn(OH)4]2-;
(1)析锌一极应是[Zn(NH3)4]2+得到电子,还原为锌,同时释放出氨气;
(2)氧化锌像氧化铝一样,属于两性氧化物,与碱反应生成锌酸盐;
Ⅱ.(1)该原电池中正极上二氧化锰得电子发生还原反应;
(2)该原电池中,负极上Zn失电子和氢氧根离子反应生成ZnO和水;
析出108gAg单质转移电子的物质的量=$\frac{10.8g}{108g/mol}$=0.1mol,串联电路中转移电子相等,根据转移电子计算需要空气体积.
解答 解:Ⅰ.含锌矿的主要成分是ZnS,焙烧与空气中氧气发生氧化还原反应,2ZnS+3O2$\frac{\underline{\;焙烧\;}}{\;}$2SO2+2ZnO,氧化锌像氧化铝一样,属于两性氧化物,加入NH3、NH4Cl溶液,得到[Zn(NH3)4]Cl2溶液,电解阳极氯离子放电,阴极[Zn(NH3)4]2++2e-═Zn+4NH3↑,氧化锌与氢氧化钠反应ZnO+2OH-+H2O═[Zn(OH)4]2-,
(1)析锌一极应是[Zn(NH3)4]2+得到电子,在阴极[Zn(NH3)4]2++2e-═Zn+4NH3↑,还原为锌,
故答案为:[Zn(NH3)4]2++2e-═Zn+4NH3↑;
(2)根据题干信息,氧化锌像氧化铝一样,属于两性氧化物,与碱反应ZnO+2OH-+H2O═[Zn(OH)4]2-,
故答案为:ZnO+2OH-+H2O═[Zn(OH)4]2-;
Ⅱ.(1)锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O═2MnO(OH)+Zn(OH)2,该原电池中正极上二氧化锰得电子发生还原反应,电极反应式为2MnO2+2H2O+2e-═2MnO(OH)+2OH-;
故答案为:2MnO2+2H2O+2e-═2MnO(OH)+2OH-;
(2)该原电池中,负极上Zn失电子和氢氧根离子反应生成ZnO和水,电极反应式为Zn-2e-+2OH-═ZnO+H2O;
析出108gAg单质转移电子的物质的量=$\frac{10.8g}{108g/mol}$=0.1mol,串联电路中转移电子相等,根据转移电子得需要空气体积=$\frac{\frac{0.1mol}{4}×22.4L/mol}{20%}$=2.8L,
故答案为:Zn-2e-+2OH-═ZnO+H2O;2.8.
点评 本题考查湿法炼锌工业、原电池原理、电解反应书写等,根据题干信息结合硫化锌的性质和电解原理是解题关键,题目难度中等

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 40 mL | B. | 72 mL | C. | 80 mL | D. | 128 mL |
| A. | 使酚酞变红色的溶液:Na+、Cu2+、Fe2+、NO3- | |
| B. | 使PH试纸变红的溶液中:Na+、Mg2+、SO42-、NH4+ | |
| C. | c(H+)=0.1mol•L-1的溶液:Na+、NH4+、SO42-、F- | |
| D. | 与铁粉反应放出H2的无色溶液:Na+、Cl-、HCO3-、SO42- |
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的3/8 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:硝酸铵
(3)Z所在族元素的四种氢化物中,沸点最低的物质的化学式为:HCl
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),阐述理由是碳酸为弱酸,其余三种酸为强酸.
| A. | 铁强化酱油可通过膳食补充人体所需的铁元素 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料 | |
| D. | 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
| A. |  | B. | 邻甲基苯酚 | C. |  | D. | 2-甲基2-己烯 |
| A. | 氯化钠的电子式: | |
| B. | 丙烷分子的比例模型: | |
| C. | NaHCO3的电离方程式NaHCO3=Na++H++CO32- | |
| D. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I |
 如图表示球棍模型,小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构.下列有关说法正确的是( )
如图表示球棍模型,小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构.下列有关说法正确的是( )| A. | M分子的所有原子共面 | |
| B. | 0.1mol/L的N溶液中H+的物质的量浓度为0.1mol/L | |
| C. | L 存在同分异构体 | |
| D. | M、L都是烃类 |
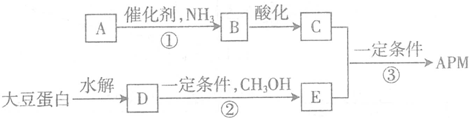
 ,C中所含官能团的名称为羧基、氨基.
,C中所含官能团的名称为羧基、氨基. .
.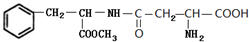 和
和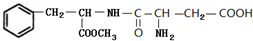 .
.