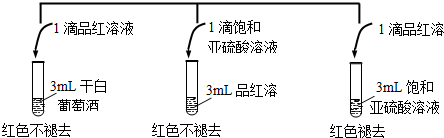
题目内容
3.如图是部分短周期主族元素原子半径与原子序数的关系.下列说法错误的是( )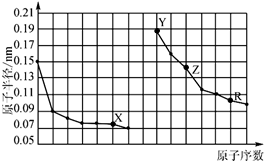
| A. | X、R的最高化合价相同 | |
| B. | 电解熔融的X与Z构成的化合物可以得到单质Z | |
| C. | X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1 | |
| D. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素.
A.氧元素没有最高正化合价.
B.电解熔融氧化铝冶炼铝;
C.X、Y形成的化合物为Na2O、Na2O2;
D.Y、Z、R对应的最高价氧化物的水化物分别为:NaOH、Al(OH)3、H2SO4,氢氧化钠与硫酸发生中和反应,氢氧化铝属于两性氢氧化物,能与强酸、强碱反应.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素.
A.X为O元素,O元素没有+6价,R为S元素,最高价为+6价,故A错误;
B.电解熔融氧化铝冶炼铝,故B正确;
C.X、Y形成的化合物为Na2O、Na2O2,化合物中阳离子与阴离子的个数比均是2:1,故C正确;
D.Y、Z、R对应的最高价氧化物的水化物分别为:NaOH、Al(OH)3、H2SO4,氢氧化钠与硫酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠、硫酸反应,故D正确,
故选:A.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
13.下表是四种盐在不同温度下的溶解度(g/100g水):
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示
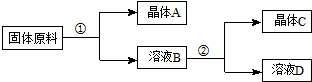
以下说法错误的是( )
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |

以下说法错误的是( )
| A. | ①和②的实验过程中,都需要控制温度 | |
| B. | ①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| C. | ②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| D. | 用95%的酒精洗涤所得的硝酸钾晶体比较好 |
14.关于煤与石油化工的说法,正确的是( )
| A. | 煤焦油干馏可得到苯、甲苯等 | |
| B. | 煤裂化可得到汽油、柴油、煤油等轻质油 | |
| C. | 石油分馏可得到乙烯、丙烯等重要化工产品 | |
| D. | 石油主要是各种烷烃、环烷烃和芳香烃组成的混合物 |
18.若氧元素只有16O、18O两种同位素,下列说法错误的是( )
| A. | 16O和18O在自然界的含量保持不变 | |
| B. | 16O和18O的质量数不同,质子数相同 | |
| C. | 16O和18O可以通过化学反应相互转化 | |
| D. | 16O和18O核外电子数相同,化学性质几乎相同 |
8.检验SO2气体中是否混有CO2的方法是( )
| A. | 先通过足量澄清石灰水,再通过足量品红溶液 | |
| B. | 先通过足量饱和NaHCO3溶液,再通过澄清石灰水 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水 | |
| D. | 先通过足量酸性KMnO4溶液,再通过澄清石灰水 |
15.现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol.则原混合气体中氢气的物质的量可能是( )
| A. | 0.03mol | B. | 0.04mol | C. | 0.05mol | D. | 0.06mol |
12.下列化学用语正确的是( )
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | H2的燃烧热为285.8kJ/mol:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8kJ/mol | |
| D. | 碳在高温下还原二氧化硅 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |