题目内容
一常见的液态碳氢化合物A,与溴水混合振荡,下层颜色变浅,上层变为棕红色.0.5molA完全燃烧时,得到27g水和67.2L二氧化碳(标准状况).请回答下列问题.
(1)A的分子式 结构简式 .
(2)A与液溴混合,在Fe的作用下发生反应生成B,写出反应的方程式 .
(3)B与NaOH溶液反应的产物经酸化后得到有机物C,C的结构简式 ,向C中加入饱和溴水,有 沉淀产生,反应的方式为 .
(4)在催化剂作用下,C与甲醛反应得到一种高聚物,该高聚物的结构简式为 .
(5)写出B与氢氧化钠溶液反应的化学方程式 .
(1)A的分子式
(2)A与液溴混合,在Fe的作用下发生反应生成B,写出反应的方程式
(3)B与NaOH溶液反应的产物经酸化后得到有机物C,C的结构简式
(4)在催化剂作用下,C与甲醛反应得到一种高聚物,该高聚物的结构简式为
(5)写出B与氢氧化钠溶液反应的化学方程式
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)根据n=
计算出水、二氧化碳的物质的量,再根据有机物的物质的量及质量守恒定律确定A的分子式,然后根据与溴水混合的现象形成其结构简式;
(2)苯与液溴在铁做催化剂条件下发生取代反应生成溴苯,据此写出反应的化学方程式;
(3)B为溴苯,溴苯与氢氧化钠溶液反应生成苯酚钠,不反应在酸性溶液中生成苯酚;苯酚与浓溴水反应生成三溴苯酚白色沉淀;
(4)苯酚与甲醛发生聚合反应生成酚醛树脂: ;
;
(5)B为 ,与氢氧化钠溶液反应生成苯酚钠和水.
,与氢氧化钠溶液反应生成苯酚钠和水.
| m |
| M |
(2)苯与液溴在铁做催化剂条件下发生取代反应生成溴苯,据此写出反应的化学方程式;
(3)B为溴苯,溴苯与氢氧化钠溶液反应生成苯酚钠,不反应在酸性溶液中生成苯酚;苯酚与浓溴水反应生成三溴苯酚白色沉淀;
(4)苯酚与甲醛发生聚合反应生成酚醛树脂:
 ;
;(5)B为
 ,与氢氧化钠溶液反应生成苯酚钠和水.
,与氢氧化钠溶液反应生成苯酚钠和水.解答:
解:(1)27g水的物质的量为:
=1.5mol,
标况下67.2L二氧化碳的物质的量为:
=3mol,
则该烃分子中含有C、H原子数为:N(C)=
=6、N(H)=
=6,
所以该烃是分子式为C6H6;
该烃与溴水混合振荡,下层颜色变浅,上层变为棕红色,溴被萃取,说明该烃分子中不含不饱和键,则该烃为苯,其结构简式为: ,
,
故答案为:C6H6; ;
;
(2),苯与液溴在Fe作催化剂条件下生成溴苯与HBr,反应的化学方程式为: +Br2
+Br2
 +HBr,
+HBr,
故答案为: +Br2
+Br2
 +HBr;
+HBr;
(3)溴苯与NaOH溶液反应生成苯酚钠,经酸化后得到有机物C,则C为 ;
;
向苯酚中加入饱和溴水,生成三溴苯酚白色沉淀,反应方程式为: +3Br2→
+3Br2→ ↓+3HBr,
↓+3HBr,
故答案为: ;白色;
;白色; +3Br2→
+3Br2→ ↓+3HBr;
↓+3HBr;
(4)在催化剂作用下,苯酚与甲醛反应得到高聚物酚醛树脂,该高聚物的结构简式为: ,
,
故答案为: ;
;
(5)溴苯与氢氧化钠溶液反应生成苯酚钠,反应的化学方程式为:C6H5OH+NaOH═C6H5ONa+H2O,
故答案为:C6H5OH+NaOH═C6H5ONa+H2O.
| 2.7g |
| 18g/mol |
标况下67.2L二氧化碳的物质的量为:
| 67.2L |
| 22.4L/mol |
则该烃分子中含有C、H原子数为:N(C)=
| 3mol |
| 0.5mol |
| 1.5mol×2 |
| 0.5mol |
所以该烃是分子式为C6H6;
该烃与溴水混合振荡,下层颜色变浅,上层变为棕红色,溴被萃取,说明该烃分子中不含不饱和键,则该烃为苯,其结构简式为:
 ,
,故答案为:C6H6;
 ;
;(2),苯与液溴在Fe作催化剂条件下生成溴苯与HBr,反应的化学方程式为:
 +Br2
+Br2 | Fe |
 +HBr,
+HBr,故答案为:
 +Br2
+Br2 | Fe |
 +HBr;
+HBr;(3)溴苯与NaOH溶液反应生成苯酚钠,经酸化后得到有机物C,则C为
 ;
;向苯酚中加入饱和溴水,生成三溴苯酚白色沉淀,反应方程式为:
 +3Br2→
+3Br2→ ↓+3HBr,
↓+3HBr,故答案为:
 ;白色;
;白色; +3Br2→
+3Br2→ ↓+3HBr;
↓+3HBr;(4)在催化剂作用下,苯酚与甲醛反应得到高聚物酚醛树脂,该高聚物的结构简式为:
 ,
,故答案为:
 ;
;(5)溴苯与氢氧化钠溶液反应生成苯酚钠,反应的化学方程式为:C6H5OH+NaOH═C6H5ONa+H2O,
故答案为:C6H5OH+NaOH═C6H5ONa+H2O.
点评:本题考查有机物分子式与结构的确定、苯及苯酚的性质等,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,明确常见有机物结构与性质是解答本题的关键.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列有关化学概念或原理的论述中,正确的是( )
| A、任何一个氧化还原反应都可以设计为电池,输出电能 |
| B、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C、电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D、任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
同温同压下,同体积的CO和CO2,下列说法不正确的是( )
| A、分子数之比等于2:3 |
| B、原子数之比等于2:3 |
| C、气体物质的量之比等于1:1 |
| D、质量之比等于7:11 |
水电解的化学方程式为2H2O
2H2↑+O2↑,某同学电解一定量的水,制得8gH2,则该8gH2的物质的量为( )
| ||
| A、2mol | B、4mol |
| C、8mol | D、89.6mol |
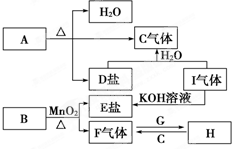 已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答:(提示:实验室制氧气可用氯酸钾与二氧化锰[作催化剂]混合加热制取)
已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答:(提示:实验室制氧气可用氯酸钾与二氧化锰[作催化剂]混合加热制取) 如图为原电池装置示意图,
如图为原电池装置示意图,
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题: