题目内容
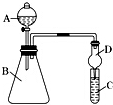 利用如图装置可以验证非金属性的变化规律.
利用如图装置可以验证非金属性的变化规律.(1)仪器A的名称为
(2)要证明非金属性:Cl>C>Si,则A中加
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:
分析:(1)仪器A的名称为分液漏斗;
(2)二氧化碳和硅酸钠反应生成难溶性的硅酸,应用强酸制弱酸的原理设计实验.
(2)二氧化碳和硅酸钠反应生成难溶性的硅酸,应用强酸制弱酸的原理设计实验.
解答:
解:(1)仪器A的名称为分液漏斗,故答案为:分液漏斗;
(2)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,二氧化碳和硅酸钠反应生成难溶性的硅酸,故答案为:稀HCl;Na2SiO3溶液.
(2)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,二氧化碳和硅酸钠反应生成难溶性的硅酸,故答案为:稀HCl;Na2SiO3溶液.
点评:本题考查了实验方案设计,涉及金属、非金属性强弱的探究,明确物质的性质是解本题关键,同时考查学生灵活运用知识解答问题的能力,题目难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、同系物的化学性质相似 |
| B、同位素的化学性质几乎相同 |
| C、分子量相同的化合物不一定同分异构体 |
| D、同分异构体间的转化属于物理变化 |
已知在1.01×105 Pa、298K条件下,2mol氢气完全燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
| A、2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
B、H2(g)+
| ||
C、H2(g)+
| ||
| D、2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
下列变化中,不需要破坏化学键的是( )
| A、氯化氢溶于水 |
| B、加热氯酸钾使其分解 |
| C、碘升华 |
| D、氯化钠溶于水 |
下列说法正确的是( )
| A、离子化合物中可以含有共价键 |
| B、共价化合物中可以含有离子键 |
| C、当元素处于最高价态时一定具有强氧化性 |
| D、元素的性质呈周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 |