题目内容
1.已知H-H、H-O和O═O键的键能分别为436kJ•mol-1,463kJ•mol-1,495kJ•mol-1,下列热化学方程式正确的是( )| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=485 kJ•mol-1 | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=485 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-485 kJ•mol-1 |
分析 旧键断裂需要吸收能量,新键的生成会放出能量,反应2H2(g)+O2(g)═2 H2O(g)的△H=反应物的键能和-生成物的键能和=2×436kJ/mol+495kJ/mol-4×463kJ/mol=-485kJ/mol,据此结合热化学方程式的书写原则判断.
解答 解:反应2H2(g)+O2(g)═2 H2O(g)的△H=反应物的键能和-生成物的键能和=2×436kJ/mol+495kJ/mol-4×463kJ/mol=-485kJ/mol,
A.水的分解为吸热反应,该反应的△H>0,正确的热化学方程式为:H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485 kJ•mol-1,故A错误;
B.水的分解是吸热反应,且反应热与化学计量数成正比,则反应H2O(g)═H2(g)+$\frac{1}{2}$O2(g)的△H=2×463kJ/mol-436kJ/mol-$\frac{1}{2}$×495kJ/mol=+242.5kJ/mol,故B错误;
C.氢气燃烧放热,该反应的△H<0,正确的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-485 kJ•mol-1,故C错误;
D.氢气燃烧放热,反应2H2(g)+O2(g)═2 H2O(g)的△H=2×436kJ/mol+495kJ/mol-4×463kJ/mol=-485kJ/mol,故D正确;
故选D.
点评 本题考查了热化学方程式的书写、反应热的计算,题目难度中等,注意掌握热化学方程式的书写原则,明确化学键与化学反应中能量变化的关系是解题关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
5.在下列反应中,既属于氧化还原反应,同时又属于吸热反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | H2与Cl2的燃烧反应 | ||
| C. | 铝与稀盐酸反应 | D. | 灼热的碳与CO2反应 |
10.在托盘天平的两个托盘上放两个质量相同的烧杯,并在烧杯中分别加入100mL 1mol•L-1硫酸.现在在天平右盘的烧杯里放入0.1mol锌,为了保持天平平衡,则应在天平左盘的烧杯里放入铁( )
| A. | 0.1mol | B. | 0.01mol | C. | 6.5g | D. | 5.6g |
11.与氖(Ne)原子电子排布相同的两种离子组成的化合物是( )
| A. | Na2S | B. | KCl | C. | MgCl2 | D. | NaF |
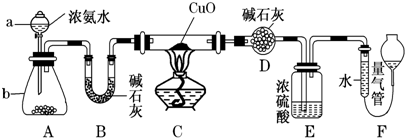
 ,A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O