题目内容
6.下列有关物质的性质或用途的叙述中,正确的是( )| A. | 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车 | |
| B. | 用氯化钡溶液可区别SO42-和CO32-离子 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硅是一种酸性氧化物,它不跟任何酸发生反应 |
分析 A.铁、铝与冷的浓硝酸或浓硫酸发生钝化;
B.反应都生成白色沉淀;
C.NO易于空气中的氧气反应;
D.二氧化硅可与HF酸反应.
解答 解:A.铁、铝与冷的浓硝酸或浓硫酸发生钝化,在表面生成一层致密的氧化物膜,起到保护作用,故A正确;
B.反应都生成白色沉淀,无法区别,故B错误;
C.NO易于空气中的氧气反应,不稳定,故C错误;
D.二氧化硅可与HF酸反应,故D错误.
故选A.
点评 本题综合考查元素化合物知识,侧重于基础知识的考查,题目难度不大,注意二氧化硅的性质,可与氢氟酸反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列化学用语或模型正确的是( )
| A. | CH3Cl  | B. | 2-氯甲苯的结构简式: | ||
| C. | 硝基苯的结构简式  | D. | CH4分子的球棍模型: |
17.下列金属可用铝热法制备的是( )
①铁 ②镁 ③锰 ④钒 ⑤铬.
①铁 ②镁 ③锰 ④钒 ⑤铬.
| A. | ①②④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
14.有些古文或谚语包含了丰富的化学知识,从化学角度解释下列古文或谚语,其中不正确的是( )
| 选项 | 古文或谚语 | 化学解释 |
| A | 日照香炉生紫烟 | 碘的升华 |
| B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
| C | 煮豆燃豆箕,豆在斧中泣 | 化学能转化为热能 |
| D | 雷雨肥庄稼 | 自然界固氮作用 |
| A. | A | B. | B | C. | C | D. | D |
1.下列离子方程式书写不正确的是( )
| A. | Fe与HCl反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与AgNO3反应:2Ag++Cu═Cu2++2Ag | |
| C. | 醋酸与NaOH反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | CuSO4与Ba(OH)2反应:Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓ |
18.含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.
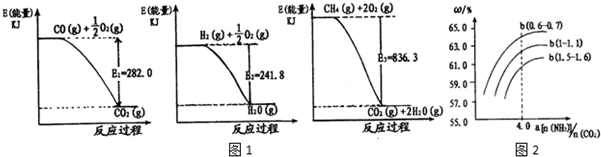
(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150C时,将0.4mol NO2气体充人体积为2L的真空密闭容器中,发生反应:2NO2(g)-?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如表:
①当反应在1500C达到平衡时,该反应平衡常数K=2.8.(填数值)
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为0.1mol/L.
(ii)氨氧化制HN03的尾气中含有NO和N02,且n(NO):n(N02)=1:1,可用尿素溶液除去,其作用原理是:N0和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76 g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)-CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.
a为[n(NH3)/n(CO2)],b为水碳比[n(H20)/n(CO2)].则:
①b应控制在C;
A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.

(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150C时,将0.4mol NO2气体充人体积为2L的真空密闭容器中,发生反应:2NO2(g)-?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如表:
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为0.1mol/L.
(ii)氨氧化制HN03的尾气中含有NO和N02,且n(NO):n(N02)=1:1,可用尿素溶液除去,其作用原理是:N0和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76 g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)-CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.
a为[n(NH3)/n(CO2)],b为水碳比[n(H20)/n(CO2)].则:
①b应控制在C;
A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.
15.关于反应CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O,下列说法错误的是( )
| A. | 该反应是可逆反应 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 使用催化剂可以加快反应速率 | |
| D. | 使用过量乙醇能使乙酸完全转化为乙酸乙酯 |
4.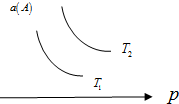 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )| A. | a+b<c | |
| B. | 若T2>T1,则该反应在高温下易自发进行 | |
| C. | △H>0 | |
| D. | 若T2<T1,则该反应一定不能自发进行 |
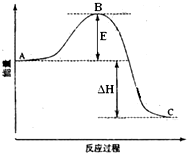 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: