题目内容
2. 氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.
氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.| 实验编号 | 反应物 |
| a | 10mL2%H2O2溶液、少量烧碱 |
| b | 10mL2%H2O2溶液 |
| c | 10mL2%H2O2溶液、少量盐酸 |
| d | 10mL5%H2O2溶液 |
(2)探究浓度对化学反应速率影响的实验编号是bd;
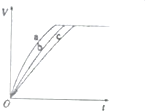
(3)实验a、b、c中,测得生成氧气的体积随时间变化的关系如图所示,分析该图能得到的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析 影响溶液时发生的化学反应的反应速率的外界主要有温度、浓度、催化剂及固体的颗粒大小等,探究反应影响反应速率的因素时要求在相同条件下进行比较,据此分析解答;
(1)过氧化氢是绿色氧化剂,其不稳定受热分解生成水和氧气;
(2)探究浓度对反应速率的影响时要保证溶液的体积相同,温度相同,保证在同一条件下进行;
(3)由图可知,a的反应速率最大,c的反应速率最小,以此来解答.
解答 解:(1)过氧化氢分解生成氧气和水的反应方程式为2H2O2=2H2O+O2↑,故答案为:2H2O2=2H2O+O2↑;
(2)b和d溶液的体积相同,但浓度不等,也没有添加催化剂,可用来探究浓度对反应速率的影响实验,故答案为:bd;
(2)由图可知,a的反应速率最大,c的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
点评 本题考查影响化学反应速率的因素,题目难度中等,试题能够较好的考查学生实验设计、数据处理、图象分析的综合能力,注意掌握温度、浓度、催化剂等因素对化学反应速率的影响.

练习册系列答案
相关题目
13.下列各组微粒在指定的环境中一定大量存在的是( )
| A. | 与铝反应产生H2的溶液中:Na+、K+、S2-、CO32- | |
| B. | 加入酚酞显红色的溶液中:K+、Na+、Cl-、CH3COO- | |
| C. | pH=2的溶液中:NH4+、Na+、Fe2+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、Al3+ |
14.下列有关物质性质的描述正确的是( )
| A. | 非金属氧化物都不能与酸反应 | B. | 含金属元素的盐溶液一定呈酸性 | ||
| C. | 组成元素相同的盐溶液酸碱性相同 | D. | 非金属元素可能形成离子化合物 |
11.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生如下反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
①写出该反应的逆反应的平衡常数表达式:K=$\frac{c{\;}^{2}(N{\;}_{2}O{\;}_{5})}{{c}^{4}(NO{\;}_{2})•c(O{\;}_{2})}$.
已知:K300℃>K350℃,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有BC.
A.再充入NO2 B.再充入4mol NO2和1mol O2
C.降低温度 D.充入氦气
③图1中表示N2O5的浓度的变化曲线是c;
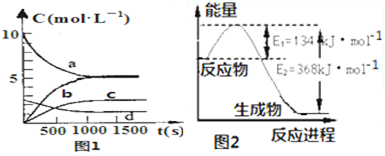
(2)图2是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图;又已知:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-760.3kJ•mol-1,
则反应:N2 (g)+2NO2 (g)?4NO(g) 的△H=+292.3kJ•mol-1.
(1)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生如下反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
已知:K300℃>K350℃,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有BC.
A.再充入NO2 B.再充入4mol NO2和1mol O2
C.降低温度 D.充入氦气
③图1中表示N2O5的浓度的变化曲线是c;

(2)图2是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图;又已知:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-760.3kJ•mol-1,
则反应:N2 (g)+2NO2 (g)?4NO(g) 的△H=+292.3kJ•mol-1.
18.在无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、Na+、ClO、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | Mg2+、NH4+、Cl-、SO42- |
11.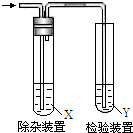 欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
 欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )| 小组 | 乙烯的制备 | 试剂X | 试剂Y |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
| A. | A | B. | B | C. | C | D. | D |
12.在100℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下:[2NO2(g)?N2O4(g)△H<0],下列说法正确的是( )
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A. | 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) | |
| B. | 平衡时,升高温度,Ⅰ中速率减慢,Ⅱ中速率加快 | |
| C. | 当密度不变时,上述反应即达平衡 | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
