题目内容
FeCl3溶液、酸性KMnO4溶液及稀HNO3都可以氧化KI变成I2,它们各自发生的变化是:①Fe3+→Fe2+ ②MnO
→Mn2+ ③HNO3→NO.如果分别用等物质的量的FeCl3溶液、酸性KMnO4溶液及稀HNO3氧化足量的KI得到I2,产生I2最多的物质是 ,最少的物质是 .
- 4 |
考点:氧化还原反应的计算
专题:
分析:反应中I-→I2,失去1个电子,而Fe3+→Fe2+得到1个电子,MnO4-→Mn2+得到5个电子,HNO3→NO得到3个电子,根据氧化还原反应氧化剂与还原剂得失电子数目相等进行判断.
解答:
解:氧化时I-,Fe3+→Fe2+得到1个电子,
MnO4-→Mn2+得到5个电子,
HNO3→NO得到3个电子,I-→I2,失去1个电子,
则分别用等物质的量的FeCl3溶液、酸性KMnO4溶液及稀HNO3氧化足量的KI得到I2,产生I2最多的物质是MnO4-,最少的物质是Fe3+.
故答案为:MnO4-;Fe3+.
MnO4-→Mn2+得到5个电子,
HNO3→NO得到3个电子,I-→I2,失去1个电子,
则分别用等物质的量的FeCl3溶液、酸性KMnO4溶液及稀HNO3氧化足量的KI得到I2,产生I2最多的物质是MnO4-,最少的物质是Fe3+.
故答案为:MnO4-;Fe3+.
点评:本题考查氧化还原反应的计算,为高频考点,注意把握元素化合价的变化,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等计算,题目难度不大.

练习册系列答案
相关题目
14.2g 69%的浓HNO3(密度为1.42g/cm3)与10mL 15.5mol/L HNO3的浓度相比( )
| A、是同一浓度的不同表示方法 |
| B、数值不同,也能换算为相同值 |
| C、不同浓度的两种硝酸溶液 |
| D、无法比较其大小 |
下列实验操作能够达到目的是( )
| A、在某溶液中逐滴加入稀盐酸,出现白色胶状沉淀,再加入足量NaOH溶液,沉淀消失,说明原溶液中存在AlO2- |
| B、在某溶液中滴加KSCN溶液时变红色,说明溶液中不存在Fe2+ |
| C、用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 |
| D、用铂丝蘸取某溶液于无色火焰上灼烧,火焰呈黄色,证明其中不含K+ |
不能用胶体的知识解释的现象是( )
| A、一支钢笔使用两种不同牌号的墨水,易出现堵塞 |
| B、向FeCl3溶液中加入NaOH溶液,出现红褐色沉淀 |
| C、医疗上常用血液透析治疗由肾功能衰竭等疾病引起的尿毒症 |
| D、江河入海处,易形成沙洲 |
具有显著抗癌活性的10-羟基喜树碱的结构如图所示,下列关于10-羟基喜树碱的说法正确的是( )


| A、分子式为C20H17N2O5 |
| B、该物质可发生消去反应 |
| C、1mol该物质可与9molH2发生加成反应 |
| D、1mol该物质可分别消耗Na、NaOH、Na2CO3的物质的量之比为2:2:1 |
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.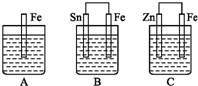 A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示: