题目内容
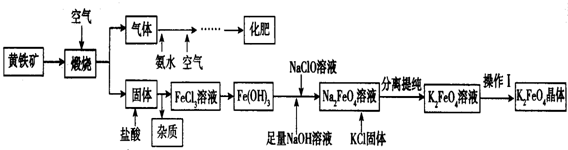
6.硝酸铜是常用的一种无机化学试剂(1)工业上以粗铜为原料采取如图1所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是将NOx转化为硝酸,提高原料的利用率,减少污染物的排放
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO调节溶液的pH,根据下表数据,溶液的pH应保持在3.2--4.7范围
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(2)某研究学习小组将一定质量的硝酸铜晶体【Cu(NO3)2.6H2O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如图2所示.据图回答下列问题:
①当温度27℃<T<120℃时,反应的化学方程式为Cu(NO3)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•3H2O+3H2O
②剩余固体质量为38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】当温度120℃<T<800℃时,反应的化学方程式为3Cu(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•2Cu(OH)2+4NO2↑+O2↑+7H2O (此温度下,HNO3也分解)
③当剩余固体质量为21.6g时,固体的化学式为Cu2O
(3)制备无水硝酸铜的方法之一是用Cu与液态N2O4反应,反应过程
中有无色气体放出,遇到空气变红棕色.反应的化学方程式是Cu+2N2O4=Cu(NO3)2+2NO↑.
分析 (1)粗铜中加入稀硝酸,Fe、Cu和稀硝酸反应生成Fe(NO3)3、Cu(NO3)2,同时生成氮氧化物,氮氧化物和水反应生成硝酸,能循环利用,调节溶液的pH,将Fe(NO3)3转化为Fe(OH)3沉淀,然后过滤得到滤渣,滤液为Cu(NO3)2溶液,向滤液中加入稀硝酸并调节溶液的pH,然后蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体,
①氮氧化物和氧气、水反应生成硝酸,提高原料利用率;
②调节溶液的pH使氢氧化铁完全沉淀,铜离子不产生沉淀,据此判断溶液的pH;加入的物质不能引进新的杂质,且要将铁离子转化为沉淀,增大溶液的pH;
③酸性条件下能抑制铜离子水解;
(2)①根据图象可知,当温度27℃<T<120℃时,硝酸铜晶体【Cu(NO3)2.6H2O】部分失去结晶水;
②根据上述分析,当温度27℃<T<120℃时,生成物为Cu(NO3)2•3H2O,剩余固体质量38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】,又因为此温度下HNO3也分解,所以当温度120℃<T<800℃时,反应的化学方程式为3Cu(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•2Cu(OH)2+4NO2↑+O2↑+7H2O;
③根据纵坐标的数据关系;
(3)Cu与液态N2O4反应,反应过程中有无色气体放出,遇到空气变红棕色,说明生成物有NO.
解答 解:(1)粗铜中加入稀硝酸,Fe、Cu和稀硝酸反应生成Fe(NO3)3、Cu(NO3)2,同时生成氮氧化物,氮氧化物和水反应生成硝酸,能循环利用,调节溶液的pH,将Fe(NO3)3转化为Fe(OH)3沉淀,然后过滤得到滤渣,滤液为Cu(NO3)2溶液,向滤液中加入稀硝酸并调节溶液的pH,然后蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体,
①氮氧化物有毒,且NO不和水反应,通入氧气和水,氮氧化物和氧气、水反应生成硝酸,硝酸能循环利用,从而提高原料利用率,且减少污染物的排放,
故答案为:将NOx转化为硝酸,提高原料的利用率,减少污染物的排放;
②调节溶液的pH使氢氧化铁完全沉淀,铜离子不产生沉淀,当溶液的pH在1.9~3.2之间,铁离子沉淀,而铜离子不产生沉淀,pH为4.7时铜离子产生沉淀,所以调节溶液的pH为3.2--4.7;
故答案为:3.2--4.7;
③铜离子水解生成氢氧化铜和氢离子,水解方程式为Cu2++2H2O?Cu(OH)2+2H+,加入稀硝酸能抑制硝酸铜溶解,
故答案为:抑制加热过程中Cu2+的水解;
(2)①根据图象可知,当温度27℃<T<120℃时,硝酸铜晶体【Cu(NO3)2.6H2O】部分失去结晶水,该反应的化学方程式为Cu(NO3)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•3H2O+3H2O↑
故答案为:Cu(NO3)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•3H2O+3H2O;
②根据上述分析,当温度27℃<T<120℃时,生成物为Cu(NO3)2•3H2O,剩余固体质量38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】,又因为此温度下HNO3也分解,所以当温度120℃<T<800℃时,反应的化学方程式为3Cu(NO3)2•3H2O=Cu(NO3)2•2Cu(OH)2+4NO2↑+O2↑+7H2O,
故答案为:3Cu(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•2Cu(OH)2+4NO2↑+O2↑+7H2O;
③根据纵坐标的数据关系,当剩余固体质量为21.6g时,固体的化学式为Cu2O;
故答案为:Cu2O
(3)Cu与液态N2O4反应,反应过程中有无色气体放出,遇到空气变红棕色.反应的化学方程式是Cu+2 N2O4=Cu(NO3)2+2NO↑,
故答案为:Cu+2 N2O4=Cu(NO3)2+2NO↑.
点评 本题以铜和酸的反应为载体考查混合物的分离和提纯,根据物质的性质、基本操作从整体上分析流程图中各个步骤发生的反应,知道图2中曲线上、下区域表示的含义,注意盐类水解的影响因素,题目难度中等.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案| A. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | |
| D. | 锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度 |
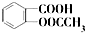 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐和水易发生反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
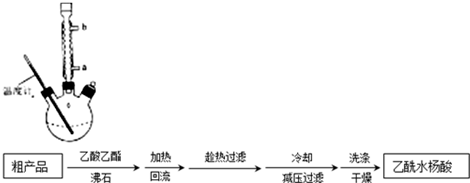
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
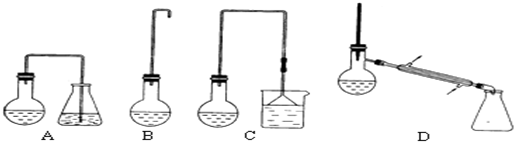
(1)制备1-溴丁烷的装置应选用上图中的C(填序号).反应加热时的温度不宜超过100℃,理由是防止1-溴丁烷因气化而逸出,影响产率且温度太高,浓硫酸氧化性增强,可能氧化溴化氢.
(2)制备操作中,加入的浓硫酸和溴化钠的作用是二者反应生成HBr.
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是D,(填序号);该操作应控制的温度(t)范围是101.6℃≤t<117.25℃.
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.Na2SO3 d.KCl.
(1)实验室制备FeCO3的流程如下:
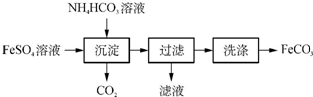
①写出生成沉淀的化学方程式:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O.
②检验滤液中含有NH4+的方法是取少量滤液于试管中,加入足量NaOH溶液,加热,若产生气体可使湿润的红色石蕊试纸变蓝,则滤液中含有NH4+.
(2)甲同学为了验证FeCO3高温下煅烧是否得到Fe2O3,做了如表实验:
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
①实验步骤Ⅲ中溶液变红的离子方程式为Fe3++3SCN-=Fe(SCN)3.
②乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+.于是乙同学对实验步骤Ⅲ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后D(填字母),用来检验溶液中是否含有Fe2+.
A.滴加氯水B.滴加KSCN溶液
C.先滴加KSCN溶液后滴加氯水D.滴加酸性KMnO4溶液
(3)丙同学认为即使得到乙同学预期的实验现象,也不能确定煅烧产物即为Fe3O4.
①丙同学持此看法的理由是氧化亚铁、四氧化三铁中也是含有+2价铁元素的.
②丙同学查阅资料得知煅烧FeCO3的产物中含有+2价铁元素,于是他设计了由FeCO3制备Fe2O3的方案.先向FeCO3粉末中依次加入试剂:稀硫酸、氯水和氢氧化钠;然后再过滤(填操作)、洗涤、灼烧即可得到Fe2O3.

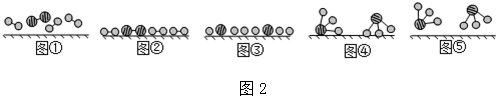
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.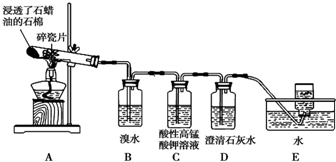
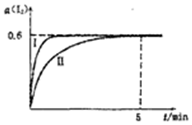 将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示
将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示