题目内容
14.工业上用黄铁矿(主要成分:FeS2,含有少量Fe2O3和SiO2,其它杂质不考虑)制备高效净水剂K2FeO4的工业流程如图: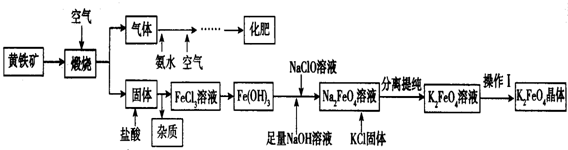
已知:25℃时,Fe(OH)3的KSP=1.0×10-38;溶液中离子浓度小于10-5mol•L-1时,认为离子沉淀完全.请回答:
(1)写出制备副产物“氮肥”的化学方程式2SO2+4NH3.H2O+O2=2(NH4)2SO4+2H2O.
(2)由FeCl3溶液制备Fe(OH)3时,若使溶液中的Fe3+沉淀完全,需调节溶液的pH至少为3.Fe(OH)3转化为Na2FeO4的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
(3)高温煅烧黄铁矿的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(4)操作I的具体步骤为蒸发浓缩、冷却结晶、过滤.
(5)检验煅烧后生成气体中有SO2的方法为将生成的气体通入品红溶液中,褪色,加热,又恢复红色,则气体为二氧化硫.
(6)工业上也可用Fe做阳极电解KOH溶液的方法制备K2FeO4,则阳极反应式为Fe+8OH--6e-=FeO42-+4H2O.
分析 黄铁矿煅烧后生成Fe2O3和SO2,向固体中加入稀盐酸,Fe2O3和HCl反应生成FeCl3和H2O,SiO2不反应,过滤得到滤液,滤液中含有FeCl3,滤渣中含有SiO2,得到的气体通入氨水中并通入空气得到硫酸铵化肥;FeCl3和碱溶液反应得到Fe(OH)3沉淀,在Fe(OH)3中加入足量NaOH溶液、NaClO溶液发生反应生成Na2FeO4,向Na2FeO4溶液中加入KCl固体,发生复分解反应生成K2FeO4,分离提纯得到K2FeO4,通过蒸发浓缩、冷却结晶、过滤得到K2FeO4晶体,
(1)二氧化硫、氨水、氧气发生氧化还原反应生成硫酸铵和水,二氧化硫是还原剂、氧气是氧化剂;
(2)当Fe3+完全沉淀时,c(Fe3+)<10-5mol•L-1,则该溶液中c(OH-)=$\root{3}{\frac{{K}_{sp}[Fe(OH)_{3}]}{c(F{e}^{3+})}}$=$\root{3}{\frac{1.0×1{0}^{-38}}{1{0}^{-5}}}$mol/L=10-11mol/L,溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L;
Fe(OH)3和NaOH、NaClO发生氧化还原反应生成Na2FeO4、NaCl和水;
(3)高温煅烧黄铁矿时,FeS2和氧气发生氧化还原反应生成氧化铁和二氧化硫;
(4)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤的方法;
(5)二氧化硫能使品红溶液褪色,可以用品红溶液检验二氧化硫;
(6)工业上也可用Fe做阳极电解KOH溶液的方法制备K2FeO4,阳极上Fe失电子和OH-反应生成FeO42-和水.
解答 解:黄铁矿煅烧后生成Fe2O3和SO2,向固体中加入稀盐酸,Fe2O3和HCl反应生成FeCl3和H2O,SiO2不反应,过滤得到滤液,滤液中含有FeCl3,滤渣中含有SiO2,得到的气体通入氨水中并通入空气得到硫酸铵化肥;FeCl3和碱溶液反应得到Fe(OH)3沉淀,在Fe(OH)3中加入足量NaOH溶液、NaClO溶液发生反应生成Na2FeO4,向Na2FeO4溶液中加入KCl固体,发生复分解反应生成K2FeO4,分离提纯得到K2FeO4,通过蒸发浓缩、冷却结晶、过滤得到K2FeO4晶体;
(1)二氧化硫、氨水、氧气发生氧化还原反应生成硫酸铵和水,二氧化硫是还原剂、氧气是氧化剂,反应方程式为2SO2+4NH3.H2O+O2=2(NH4)2SO4+2H2O,
故答案为:2SO2+4NH3.H2O+O2=2(NH4)2SO4+2H2O;
(2)当Fe3+完全沉淀时,c(Fe3+)<10-5mol•L-1,则该溶液中c(OH-)=$\root{3}{\frac{{K}_{sp}[Fe(OH)_{3}]}{c(F{e}^{3+})}}$=$\root{3}{\frac{1.0×1{0}^{-38}}{1{0}^{-5}}}$mol/L=10-11mol/L,溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,溶液的pH=3;
Fe(OH)3和NaOH、NaClO发生氧化还原反应生成Na2FeO4、NaCl和水,离子方程式为 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:3; 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(3)高温煅烧黄铁矿时,FeS2和氧气发生氧化还原反应生成氧化铁和二氧化硫,反应方程式为 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(4)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤的方法,所以操作I为蒸发浓缩、冷却结晶、过滤,
故答案为:蒸发浓缩、冷却结晶、过滤;
(5)二氧化硫能使品红溶液褪色,可以用品红溶液检验二氧化硫,其检验方法为将生成的气体通入品红溶液中,褪色,加热,又恢复红色,则气体为二氧化硫,
故答案为:将生成的气体通入品红溶液中,褪色,加热,又恢复红色,则气体为二氧化硫;
(6)工业上也可用Fe做阳极电解KOH溶液的方法制备K2FeO4,阳极上Fe失电子和OH-反应生成FeO42-和水,电极反应式为Fe+8OH--6e-=FeO42-+4H2O,故答案为:Fe+8OH--6e-=FeO42-+4H2O.
点评 本题以化学工艺流程为载体考查物质制备,为高频考点,涉及氧化还原反应、电解原理、物质检验、难溶物溶解平衡、物质分离提纯等知识点,侧重考查学生对化学反应原理、元素化合物知识的理解和掌握及化学知识的综合运用能力,难点是电极反应式的书写,能从整体上把握分析工艺流程是解本题关键,题目难度中等.

| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,溶液中30s内不恢复原色;
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2;
③该试样中CuCl2•2H2O的质量百分数为95%.
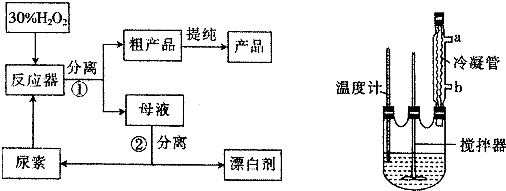
过氧化尿素的部分参数见表:
| 分子式 | 外观 | 热分解温度 | 熔点 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ |
(2)反应器中发生反应的化学方程式为CO(NH2)2+H2O2=CO(NH2)2•H2O2;
(3)反应器中冷凝管中的冷水从b(填“a”或“b”)口流进,反应器加热温度不能太高的原因是温度过高,产品易分解,致使活性氧含量降低;
(4)搅拌器不能选择铁质或铝质材料的原因是铝、铁易被氧化;
(5)为测定产品中过氧化尿素的含量,称取干燥样品12.0g,溶于水,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL6mol/L硫酸,然后用0.20mol/L的KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如表:
| 实验序号 | 1 | 2 | 3 | |
| KMnO4溶液的体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
| 滴定后读数 | 19.98 | 20.00 | 22.02 | |
②若滴定前滴定管尖嘴处无气泡,滴定后有气泡.则会使测得的过氧化尿素的含量偏低 (填“偏高”“偏低”或“不变”).
③产品中过氧化尿素的质最分数为78.3%.
(1)工业上以粗铜为原料采取如图1所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是将NOx转化为硝酸,提高原料的利用率,减少污染物的排放
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO调节溶液的pH,根据下表数据,溶液的pH应保持在3.2--4.7范围
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(2)某研究学习小组将一定质量的硝酸铜晶体【Cu(NO3)2.6H2O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如图2所示.据图回答下列问题:
①当温度27℃<T<120℃时,反应的化学方程式为Cu(NO3)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•3H2O+3H2O
②剩余固体质量为38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】当温度120℃<T<800℃时,反应的化学方程式为3Cu(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•2Cu(OH)2+4NO2↑+O2↑+7H2O (此温度下,HNO3也分解)
③当剩余固体质量为21.6g时,固体的化学式为Cu2O
(3)制备无水硝酸铜的方法之一是用Cu与液态N2O4反应,反应过程
中有无色气体放出,遇到空气变红棕色.反应的化学方程式是Cu+2N2O4=Cu(NO3)2+2NO↑.




 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下: