题目内容
8.用 Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法正确的是( )| A. | Zn片是正极,Cu片是负极 | B. | 电流方向是从Zn经外电路流向Cu | ||
| C. | 电解液的PH保持不变 | D. | Cu片上有气泡产生 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,以此解答.
解答 解:A、锌比铜活泼,应为原电池的负极,发生氧化反应,铜为正极,发生还原反应,则A错误;
B、电流从正极流向负极,则从铜片经导线流向锌片,故B错误;
C、正极上氢离子得电子发生还原反应,则氢离子浓度减小,所以反应一段时间后,溶液的pH升高,故C错误;
D、铜为正极,发生还原反应即2H++2e-=H2↑,所以Cu片上有气泡产生,故D正确.
故选D.
点评 本题考查原电池池知识,侧重于学生的分析能力和电化学知识的综合考查,注意把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
2.短周期元素X、Y、Z、W的原子序数依次增大,其中,X和Z处于同一主族,而Y和W也处于同一主族.Z的单质可与冷水反应生成X的单质,WY2是一种常见的大气污染物.则下列有关说法不正确的是( )
| A. | 元素Y的单质与其他三种元素的单质都可发生反应 | |
| B. | 由上述四种元素组成的某种化合物的水溶液呈强酸性 | |
| C. | 在Y与Z形成的两种常见化合物中,阴阳离子个数比相同 | |
| D. | 常温下,铁、铝均可与W的最高价含氧酸的浓溶液发生剧烈反应 |
13.NaOH、KOH等碱溶液可以贮存在下列哪种试剂瓶中( )
| A. |  | B. |  | C. |  | D. | 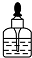 |
18.下列说法错误的是( )
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸收能量反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 |
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: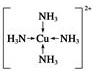 .
.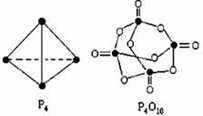 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1根据图示的分子结构和有关数据计算该反应的反应热(6a+5d-4c-12b)kJ•mol-1.
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1根据图示的分子结构和有关数据计算该反应的反应热(6a+5d-4c-12b)kJ•mol-1.