题目内容
12.(1)某课外活动小组利用如图1装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管.请填写下列空白: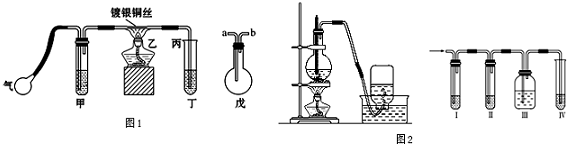
①甲装置常常浸在70~80℃的水浴中,目的是使生成乙醇蒸汽的速率加快.
②实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态.若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束.乙醇的催化氧化反应是放热反应(填“放热”或“吸热”),该反应的化学方程式为2CH3CH2OH+O2$→_{加热}^{镀银铜丝}$2CH3CHO+H2O.
③若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接b、a接丙.
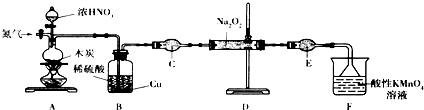
(2)实验室制取乙烯的装置如图2:
①实验室制取乙烯的方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
②实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有二氧化硫并验证乙烯具有还原性.装置Ⅰ应盛放的试剂是品红溶液;Ⅳ应盛放的试剂是酸性高锰酸钾溶液,能验证乙烯具有还原性的现象是装置I中品红溶液褪色,装置Ⅲ中品红不褪色,装置Ⅳ中酸性高锰酸钾溶液褪色.
分析 (1)①乙醇易挥发,温度越高越易挥发,升高温度能促进乙醇的挥发;
②该反应引发后,不需加热即可进行,说明反应是放热的;乙醇催化氧化可以生成乙醛;
③为防止倒吸可以在乙、丙之间接上戊装置,起到安全瓶的作用,安全瓶中的导气管是“短进长出;
(2)①乙醇在浓硫酸的作用下反应得到乙烯;
②温度过高混有杂质气体二氧化硫,由装置可知,I中检验二氧化硫用品红溶液,II中NaOH除去二氧化硫,Ⅲ中品红检验二氧化硫除尽,Ⅳ中用酸性高锰酸钾溶液验证乙烯的还原性.
解答 解:(1)①乙醇具有挥发性,升高温度能促进乙醇的挥发,使生成乙醇蒸气的速率加快,
故答案为:使生成乙醇蒸气的速率加快;
②实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化生成乙醛和水,方程式为 2CH3CH2OH+O2$→_{加热}^{镀银铜丝}$2CH3CHO+H2O,故答案为:放热; 2CH3CH2OH+O2$→_{加热}^{镀银铜丝}$2CH3CHO+H2O;
③为防止防止丁中水倒吸,安全瓶中的导气管是“短进长出”,所以乙接b,a接,
故答案为:b;a;
(2)①实验室制取乙烯的化学方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
②由实验目的可知,确认上述混合气体中有乙烯和二氧化硫,I中试剂为品红溶液,II中试剂为NaOH溶液,Ⅲ中试剂为品红溶液,Ⅳ中试剂为酸性高锰酸钾溶液,能说明二氧硫存在的现象是装置I中品红溶液褪色,使用装置Ⅱ的目的是除去二氧化硫以免干扰乙烯的检验,使用装置Ⅲ的目的是检验二氧化硫是否除尽,验证乙烯还原性的现象为装置Ⅲ中品红不褪色,装置Ⅳ中酸性高锰酸钾溶液褪色,
故答案为:装置I中品红溶液褪色,装置Ⅲ中品红不褪色,装置Ⅳ中酸性高锰酸钾溶液褪色.
点评 本题考查了乙醇的催化氧化实验以及消去反应,把握物质的性质、检验及实验装置的作用为解答的关键,注意安全瓶连接方法、检验乙烯应排除二氧化硫的干扰,题目难度不大.

 寒假学与练系列答案
寒假学与练系列答案 在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )
在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:饱和食盐水和HCl | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢 |
| A. |  向容量瓶中转移溶液 | B. |  制氢氧化亚铁 | ||
| C. | 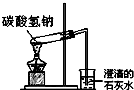 碳酸氢钠受热分解 | D. |  萃取 |
| A. | 水泥 | B. | 玻璃 | C. | 陶瓷 | D. | 水晶 |
| A. | 苯与浓硫酸反应 | B. | 乙醇与HBr溶液共热制溴乙烷 | ||
| C. | 乙醇和浓硫酸共热至170℃ | D. | 油脂与强碱水溶液反应 |
| A. | 大量水 | B. | 碘化钾溶液 | C. | 饱和食盐水 | D. | 饱和NaHCO3溶液 |
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 可用乙醇萃取溴水中的溴 | |
| D. | 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: