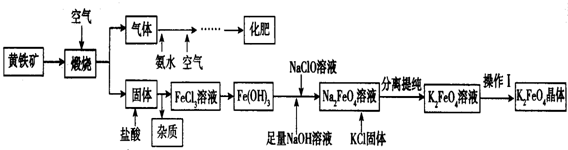
题目内容
4.(1)请写出过量铁粉与稀硝酸反应的离子方程式为式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;在标准状况下,当生成2.24L NO气体时,转移电子的物质的量为0.3mol,有0.1mol氧化剂被还原.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++1═Mn2++5Fe3++4H2O
(3)完成“氧化除铁”步骤中反应的离子方程式:
2Fe(OH)2+1ClO-+H2O═2Fe(OH)3+1Cl-.
分析 (1)铁与过量的稀硝酸反应生成硝酸亚铁、NO和水,根据氮元素的化合价变化为+5→+2,结合得失电子守恒和氮原子守恒解答;
(2)MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,结合电子、电荷守恒及原子守恒分析;
(3)“氧化除铁”是加入漂白粉,产物中有氯离子,氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,配平方程式即可.
解答 解:(1)过量铁与稀硝酸反应生成硝酸亚铁、NO和水,其反应的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,标准状况下,当生成2.24L NO气体时,其物质的量为0.1mol,转移0.2mol×(5-2)=0.3mol电子,氮元素的化合价变化为+5→+2,由N原子守恒可知,0.1mol氧化剂被还原,
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;0.3;0.1;
(2)反应中MnO4-→Mn2+,Fe2+→Fe3+,MnO4-系数为1,根据电子转移守恒可知,Fe2+系数为5,由元素守恒可知,Fe3+系数为5,由电荷守恒可知,由H+参加反应,其系数为8,根据元素原子守恒可知,有H2O生成,其系数为4,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:1、5、1、5、4H2O;
(3)“氧化除铁”是加入漂白粉,产物中有氯离子,氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,反应的离子方程式为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-,
故答案为:2;1;H2O;2;1.
点评 本题考查有关金属元素以及化合物有关反应知识,题目难度中等,注意Fe与硝酸的离子方程式,侧重于考查学生的分析能力和计算能力.

| A. | 用托盘天平称取NaCl固体2.9 g | |
| B. | 胶头滴管加水定容时,有少量水滴到容量瓶外 | |
| C. | 定容时俯视读数 | |
| D. | 称量固体时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确 |

 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.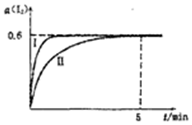 将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示
将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示