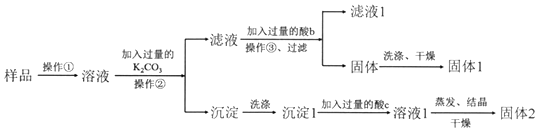
题目内容
3.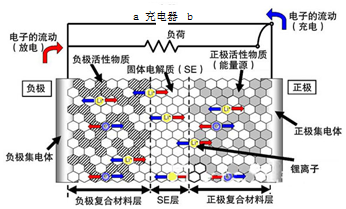 新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )| A. | 电池放电时,负极发生的反应为:nC+xLi++xe-═LixCn | |
| B. | 充电器的a端接电源的负极,b端接电源的正极 | |
| C. | 电池充电时Li+自左向右移动 | |
| D. | 电池工作时,固体电解质因熔融而导电 |
分析 A、电池放电时,负极发生氧化反应;
B、可充可放电池,原电池的正极是电解的阳极,原电池的负极是电解池的阴极;
C、电池充电是电解池,电解池中阳离子向阴极移动;
D、电池工作时,固体电解质因离子的定向移动而导电.
解答 解:A、电池放电时,负极发生氧化反应,所以负极的电极反应式为:nC+xLi+-xe-═LixCn,故A错误;
B、放电时a为负极,所以充电是阴极,与电源的负极相连,所以b端接电源的正极,故B正确;
C、电池充电是电解池,电解池中阳离子向阴极移动,所以Li+自右向左移动,故C错误;
D、电池工作时,固体电解质因离子的定向移动而导电,而不是熔融,故D错误;
故选B.
点评 本题考查化学电源新型电池,侧重考查原电池和电解池原理,明确充放电各个电极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
4.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 乙醛 | C. | 四氯化碳 | D. | 丙烯 |
5.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 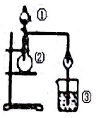 |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2C03 | Na2Si03 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
11.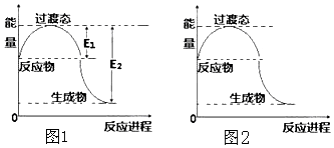 回答下列问题:
回答下列问题:
(1)2molCH4(g)和4mol O2(g)反应生成CO2(g)和H2O(g)过程中的能量变化如图1所示.已知E1=134KJ,E2=368KJ.则热化学方程式为2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=-234 kJ•mol-1生成18g H2O(l)放出或吸收的能量(范围)>58.5KJ
请在图2中画出加入催化剂后,反应过程中的能量变化曲线.
(2)在一定条件下,已知下列反应的热化学反应式:
C(石墨,s)+O2(g)=CO2(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3
由C(石墨,s)和气态H2反应合成气态1mol C2H2的热化学方程式2C (s,石墨)+H2(g)=C2H2(g))△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3;
(3)工业上可通过CO(C≡O)和H2化合制得CH3OH(气态),各键能数据如表所示
写出合成1mol CH3OH(气态)的热化学方程式CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1.
 回答下列问题:
回答下列问题:(1)2molCH4(g)和4mol O2(g)反应生成CO2(g)和H2O(g)过程中的能量变化如图1所示.已知E1=134KJ,E2=368KJ.则热化学方程式为2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=-234 kJ•mol-1生成18g H2O(l)放出或吸收的能量(范围)>58.5KJ
请在图2中画出加入催化剂后,反应过程中的能量变化曲线.
(2)在一定条件下,已知下列反应的热化学反应式:
C(石墨,s)+O2(g)=CO2(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3
由C(石墨,s)和气态H2反应合成气态1mol C2H2的热化学方程式2C (s,石墨)+H2(g)=C2H2(g))△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3;
(3)工业上可通过CO(C≡O)和H2化合制得CH3OH(气态),各键能数据如表所示
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
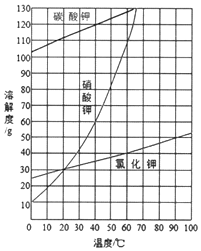
15.在恒温、密闭容器中投入一定量的CaCO3发生分解反应:CaCO3(s)?CaO(s)+CO2(g)△H>0达到平衡时,测得体系中气体的压强为P.若温度不变,缩小体积至原来的一半,重新达到平衡.下列说法的错误是( )
| A. | 当CaCO3的浓度不再变化时,表明达到平衡状态 | |
| B. | 重新达到新平衡时,CO2的压强为P | |
| C. | 扩大容器体积,重新达到平衡时n(CO2)增多 | |
| D. | 常温常压下CaCO3的分解反应不一定自发 |
12.某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
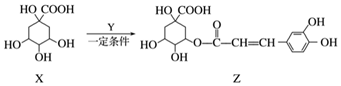
下列有关叙述中不正确的是( )

下列有关叙述中不正确的是( )
| A. | Z结构中有1个手性碳原子 | |
| B. | Y的分子式为C9H8O4 | |
| C. | 1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH | |
| D. | Z与浓溴水既能发生取代反应又能发生加成反应 |
13.在任何条件下,纯水显中性,是因为( )
| A. | PH=7 | B. | c(H+)=c(OH-) | ||
| C. | c(H+)=c(OH-)=10-7mol/L | D. | c(H+)•c(OH-)=10-14 |