题目内容
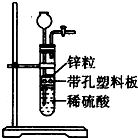 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④苯⑤Na2C03溶液⑥KCl溶液.( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④苯⑤Na2C03溶液⑥KCl溶液.( )| A、①②③ | B、②④⑤ |
| C、①②④⑥ | D、②③⑥ |
考点:气体发生装置
专题:化学实验基本操作
分析:根据锌与非氧化性酸反应产生H2,增大溶液的体积即可接触而发生反应,注意锌与强氧化性酸反应不生成氢气.
解答:
解:①因加入NaNO3溶液,相当于稀硫酸进行稀释,同时液面上升,但溶液中含有NO3-,与金属发生反应,产生NO,故①错误;
②因酒精能与水互溶,相当于稀硫酸进行稀释,同时液面上升,与金属发生反应,故②正确;
③因四氯化碳不溶于水,且密度比水大,加入四氯化碳,液面上升,稀硫酸在上层,与金属反应,故③正确;
④因苯不溶于水,且密度比水小,加入苯,液面上升,苯在上层,但苯与金属不反应,故④错误;
⑤因Na2CO3溶液与稀硫酸反应,产生二氧化碳气体,使氢气不纯,故⑤错误;
⑥因加入KCl,相当于稀硫酸进行稀释,同时液面上升,与金属发生反应,故⑥正确;
故选D.
②因酒精能与水互溶,相当于稀硫酸进行稀释,同时液面上升,与金属发生反应,故②正确;
③因四氯化碳不溶于水,且密度比水大,加入四氯化碳,液面上升,稀硫酸在上层,与金属反应,故③正确;
④因苯不溶于水,且密度比水小,加入苯,液面上升,苯在上层,但苯与金属不反应,故④错误;
⑤因Na2CO3溶液与稀硫酸反应,产生二氧化碳气体,使氢气不纯,故⑤错误;
⑥因加入KCl,相当于稀硫酸进行稀释,同时液面上升,与金属发生反应,故⑥正确;
故选D.
点评:本题主要考查了实验基础知识,化学实验知识比较零碎,要靠平时的点滴积累.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液.
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液.
| A、①⑤ | B、③④⑤ |
| C、②⑥ | D、②③④⑥ |
硝基苯中溶有少量CaCl2,适宜的提纯方法是( )
| A、过滤 | B、蒸馏 |
| C、分液 | D、纸上层析 |
下列说法中,正确的是( )
| A、硅胶的主要成分是硅酸钠 |
| B、明矾和氯化铁都可作净水剂 |
| C、发酵粉的主要成分是碳酸钠 |
| D、光导纤维的主要材料是晶体硅 |
 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤: