题目内容
13.许多元素都存在同位素,同位素在日常生活、工农业生产和科学研究等方面具有很重要的用途,如临床治癌、研究反应机理、核动力发电等.①国际上一致以碳元素的一种核素--12C原子质量的$\frac{1}{12}$作为标准来衡量各种原子的相对原子质量.
②据报道,上海某医院正在研究用放射性同位素${\;}_{53}^{115}$I治疗肿瘤.该同位素原子核内的中子数是72,该原子的质量是上述碳原子质量的$\frac{125}{12}$倍.
③硼元素只有两种天然同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,硼元素的近似相对原子质量为10.8,则天然硼元素中${\;}_{5}^{11}$B的质量分数为81.5%.
④已知反应:KClO3+6HCl=KCl+3Cl2+3H2O,若用K35ClO3与H37Cl作用,则所得氯气的相对分子质量为73.3.
分析 ①作为相对原子质量标准的核素为12C;
②根据中子数=质量数-质子数计算;根据原子质量之比等于质量数之比;
③硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,再根据M=$\frac{m}{n}$计算其物质的量之比,利用物质的量计算其质量百分比;
④反应方程式:K35ClO3+6H37Cl=K37Cl+Cl2↑+3H2O生成的Cl2中,35Cl与37Cl个数比为1:5,然后根据摩尔质量与相对分子质量在数值上相等求解.
解答 解:①国际上一致以12C原子质量的$\frac{1}{12}$作为标准来衡量各种原子的相对原子质量;
故答案为:12C;
②${\;}_{53}^{115}$I的质子数为53,质量数为115,中子数=115-53=72,根据原子质量之比等于质量数之比可知,该原子的质量是上述碳原子质量的$\frac{125}{12}$倍;
故答案为:72;$\frac{125}{12}$;
③硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,
设10B和11B的物质的量分别是xmol、ymol,则$\frac{10g/mol×xmol+11g/mol×ymol}{(x+y)mol}$=10.8g/mol,
解得:x:y=1:4,设10B和11B的物质的量分别是1mol、4mol,
则115B的质量百分比是$\frac{4mol×11g/mol}{4mol×11g/mol+1mol×10g/mol}$×100%≈81.5%;
故答案为:81.5%;
④反应方程式:K35ClO3+6H37Cl=K37Cl+Cl2↑+3H2O生成的Cl2中,35Cl与37Cl个数比为1:5,35Cl与37Cl个数比为1:5,生成的氯气相对分子质量约为$\frac{37×5+35}{3}$=73.3;
故答案为:73.3;
点评 本题考查同位素的应用、原子的构成及相对原子质量的计算,侧重分析与计算能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | HA是一种强酸 | B. | 反应后溶液中c(OH-)<c(H+) | ||
| C. | c(A-)>c(B+)>c(H+)>c(OH-) | D. | 反应后混合溶液中还含有HA分子 |
| A. | H2O | B. | CaCl2 | C. | KOH | D. | NH3 |
①钾的焰色反应--紫色;②淀粉碘化钾溶液遇碘离子--蓝色;③溴化银见光分解--白色;④适量的氯气通入KBr溶液--橙色;⑤新制氯水久置后--无色;⑥铜在氯气中燃烧产生的烟--棕黄色.
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③④⑥ | D. | ①③④⑤⑥ |
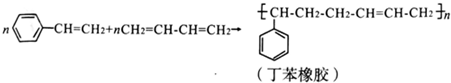
下列有关说法错误的是( )
| A. | 丁苯橡胶的两种单体都属于烃 | B. | 丁苯橡胶不能使溴水褪色 | ||
| C. | 上述反应的原子利用率为100% | D. | 丁苯橡胶属于高分子化合物 |
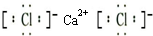 .
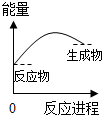
.
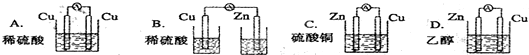
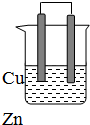 由铜、锌和稀硫酸组成的原电池中:
由铜、锌和稀硫酸组成的原电池中: