题目内容
5.下列物质的水溶液因水解显碱性的是( )| A. | NH4Cl | B. | NaOH | C. | CH3COOK | D. | CH3COOH |
分析 水溶液显碱性的有两类,一是碱溶液,二是水解呈碱性的盐溶液,以此判断.
解答 解:A、氯化铵是强酸弱碱盐,在水溶液中水解显酸性,故A错误;
B、NaOH是强碱,在水溶液中电离出氢氧根而使溶液显碱性,故B错误;
C、醋酸钾是强碱弱酸盐,在溶液中水解显碱性,故C正确;
D、醋酸是弱酸,在溶液中电离显酸性,故D错误.
故选C.
点评 本题考查盐类的水解的应用,题目难度不大,注意盐类水解的原理,把握盐类水解的应用,为中学阶段常考查知识.

练习册系列答案
相关题目
16.把24mL的NO2气体,依次通过下列3个分别装有①NaHCO3饱和溶液、②浓H2SO4、③Na2O2的装置后,用排水法把残留气体收集到集气瓶中,集气瓶内气体应是(同温同压下测定)( )
| A. | 2mLNO | B. | 8mLNO2和4mLO2 | C. | 2mLO2 | D. | 0.25mLO2 |
10.下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3( )
| A. | ①③④ | B. | ②③④⑤ | C. | ①②③④ | D. | 全部 |
17.①乙烷 ②戊烷 ③2-甲基丁烷,其沸点排列顺序正确的是( )
| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ②>①>③ |
14.Fe和Fe2O3的混合物15g,加入150mL稀硫酸中,标准状况下放出H21.68L,同时固体全部溶解.向溶液中滴加硫氰化钾溶液后,未见颜色变化.若向溶液中加入3mol•L-1 NaOH溶液200mL,恰好使铁元素全部沉淀.则该稀硫酸的物质的量浓度为( )
| A. | 2.25mol•L-1 | B. | 2mol•L-1 | C. | 0.6mol•L-1 | D. | 0.3mol•L-1 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol/L的NaNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使pH试纸显红色的溶液:NH4+、Ba2+、HCO3-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CO32-、SO42- | |
| D. | 与铝粉反应产生大量氢气的溶液:Na+、K+、Fe3+、NO3- |

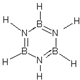 ,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.
,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.