题目内容
13.下列是中学常见的一些物质之间的转化关系(其中部分反应产物省略),其中I是一种金属单质,A是一种黄绿色的非金属单质;F、M、N均为难溶于水的白色沉淀物质,M和N不溶于稀硝酸;B是一种具有刺激性气味的气体,且具有漂白性;C和D是中学化学中两种常见的强酸.请回答下列问题: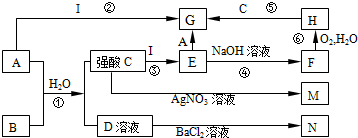
(1)写出物质B和M的化学式:B.SO2,M.AgCl;
(2)写出E→G转化反应的离子方程式:2 Fe2++Cl2=2 Fe3++2Cl-;
(3)写出反应⑥的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)写出反应①的离子方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-.
分析 A是一种黄绿色的非金属单质,则A为Cl2,B是一种具有刺激性气味的气体,且具有漂白性,与氯气、水反应得到C和D是中学化学中两种常见的强酸,则B为SO2,D与氯化钡溶液反应得到白色沉淀N,则C为HCl,D为H2SO4,N为BaSO4.C与硝酸银反应得到白色沉淀M为AgCl,金属I与盐酸反应得到E,E与氯气反应得到G,而I与氯气反应也得到G,则I为变价金属,则I为Fe,可推知E为FeCl2,F为Fe(OH)2,H为Fe(OH)3,G为FeCl3,据此解答.
解答 解:A是一种黄绿色的非金属单质,则A为Cl2,B是一种具有刺激性气味的气体,且具有漂白性,与氯气、水反应得到C和D是中学化学中两种常见的强酸,则B为SO2,D与氯化钡溶液反应得到白色沉淀N,则C为HCl,D为H2SO4,N为BaSO4.C与硝酸银反应得到白色沉淀M为AgCl,金属I与盐酸反应得到E,E与氯气反应得到G,而I与氯气反应也得到G,则I为变价金属,则I为Fe,可推知E为FeCl2,F为Fe(OH)2,H为Fe(OH)3,G为FeCl3.
(1)B的化学式为SO2,M的化学式为AgCl,故答案为:SO2;AgCl;
(2)E→G转化反应的离子方程式:2 Fe2++Cl2=2 Fe3++2Cl-,故答案为:2 Fe2++Cl2=2 Fe3++2Cl-;
(3)反应⑥的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)反应①的离子方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-,故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-.
点评 本题考查无机物的推断,题目难度中等,题目中物质的性质是推断突破口,需要学生熟练掌握元素化合物性质.

| A. |  溶解食盐 | B. |  蒸发结晶 | C. |  进行定容 | D. |  收集NO2 |
| A. | Fe3+ NH4+ SCN- Cl- | B. | Fe3+ Fe2+ Na+ NO3- | ||
| C. | Ba2+ H+ NO3- SO42- | D. | S2- Na+ ClO- OH- |
| A. | Na2CO3、CH3COONa、KCl、NH4NO3、NaHSO4 | |
| B. | Na2CO3、CH3COONa、NaHSO4、NH4NO3、KCl | |
| C. | Na2CO3、KCl、NH4NO3、NaHSO4、CH3COONa | |
| D. | Na2CO3、NH4NO3、CH3COONa、NaHSO4、KCl |
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
| A. | 当溶液pH<4,碳钢主要发生析氢腐蚀 | |
| B. | 当溶液pH>13.5,碳钢腐蚀的正极反应式为O2+4H++4e-=2H2O | |
| C. | 当溶液pH>6,碳钢主要发生吸氧腐蚀 | |
| D. | 煮沸除去氧气的碱性溶液中,碳钢腐蚀速率会减缓 |
| A. | NH4Cl | B. | NaOH | C. | CH3COOK | D. | CH3COOH |
| A. | 反应后溶液中NO3-的物质的量为0.7 mol | |
| B. | 硝酸有剩余,铁粉反应完 | |
| C. | 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1:2 | |
| D. | 该硝酸的浓度为12 mol•L-1 |
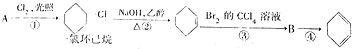
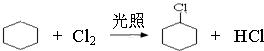 ,②的反应类型是消去反应.
,②的反应类型是消去反应. .
.