题目内容
14.Fe和Fe2O3的混合物15g,加入150mL稀硫酸中,标准状况下放出H21.68L,同时固体全部溶解.向溶液中滴加硫氰化钾溶液后,未见颜色变化.若向溶液中加入3mol•L-1 NaOH溶液200mL,恰好使铁元素全部沉淀.则该稀硫酸的物质的量浓度为( )| A. | 2.25mol•L-1 | B. | 2mol•L-1 | C. | 0.6mol•L-1 | D. | 0.3mol•L-1 |
分析 反应后的溶液中加入NaOH溶液,恰好使Fe2+全部转化为Fe(OH)2,溶液中溶质为Na2SO4,根据硫酸根守恒,则n(H2SO4)=n(Na2SO4),根据钠离子守恒,则n(Na2SO4)=$\frac{1}{2}$n(NaOH),据此计算出原硫酸溶液中硫酸的物质的量,再根据c=$\frac{n}{V}$计算出该硫酸的浓度.
解答 解:反应后的溶液中加入NaOH溶液,恰好使Fe2+全部转化为Fe(OH)2,溶液中溶质为Na2SO4,根据硫酸根守恒:n(H2SO4)=n(Na2SO4),根据钠离子守恒可得:n(Na2SO4)=$\frac{1}{2}$n(NaOH),
则:n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×3mol/L×0.2L=0.3mol,
该稀硫酸的物质的量浓度为:c(H2SO4)=$\frac{0.3mol}{0.15L}$=2mol/L,
故选B.
点评 本题考查混合物的有关计算,题目难度中等,明确发生的反应实质是关键,注意利用守恒方法进行的计算,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
4.下列离子在溶液中能大量共存的是( )
| A. | Fe3+ NH4+ SCN- Cl- | B. | Fe3+ Fe2+ Na+ NO3- | ||
| C. | Ba2+ H+ NO3- SO42- | D. | S2- Na+ ClO- OH- |
5.下列物质的水溶液因水解显碱性的是( )
| A. | NH4Cl | B. | NaOH | C. | CH3COOK | D. | CH3COOH |
9.氢氧化铁胶体稳定存在的主要原因是( )
| A. | 胶粒直径小于1nm | B. | 胶粒作布朗运动 | ||
| C. | 胶粒带正电荷 | D. | 胶粒不受重力作用 |
19.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在密闭容器中加入1molN2和3molH2充分反应可得到NH3分子数为2NA | |
| B. | 20 g重水(D2O)中含有的电子数为10NA | |
| C. | 粗铜电解精炼时,阳极质量减少6.4 g,则转移电子数一定是0.2NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
3.加热条件下把16.8g铁粉完全溶解于100mL某浓度的硝酸中,如反应只收集到0.4mol NO2和0.1mol NO,下列说法不正确的是( )
| A. | 反应后溶液中NO3-的物质的量为0.7 mol | |
| B. | 硝酸有剩余,铁粉反应完 | |
| C. | 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1:2 | |
| D. | 该硝酸的浓度为12 mol•L-1 |
10.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙,下列有关物质的推断不正确的是( )
| A. | 若甲为Fe,则丁可能是Cl2 | B. | 若甲为焦炭,则丁可能是O2 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是CO2 |
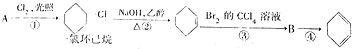
 ,②的反应类型是消去反应.
,②的反应类型是消去反应. .
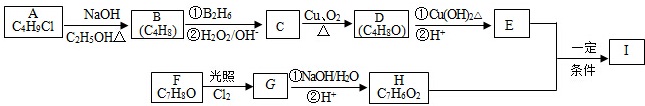
.
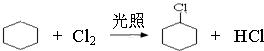
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.