题目内容
3.4克A和1.6克B恰好完全反应生成C和D,其中D的质量为1.8克,若10克A与4克B反应生成0.125摩尔C,则C的摩尔质量是多少?
考点:化学方程式的有关计算
专题:
分析:根据质量守恒定律计算3.4克A和1.6克B恰好完全反应生成C和D,其中D的质量为1.8克,所以C的质量为3.4g=1.6g-1.8g,再根据质量定比关系计算10gA反应需要B的质量,判断A是否过量,再根据不足量的物质利用质量定比关系计算生成C的质量,根据M=
计算C的摩尔质量.
| m |
| n |
解答:
解:由3.4克A和1.6克B恰好完全反应生成C和D,其中D的质量为1.8克,所以C的质量为3.4g=1.6g-1.8g=3.2g,10克A与4克B反应,若A完全反应,需要的B为10g×
=4.7g,则B不足,B完全反应,
生成C的质量为4g×
=2g,摩尔质量是
=16g/mol,
答:C的摩尔质量是16g/mol.
| 1.6 |
| 3.4 |
生成C的质量为4g×
| 1.6 |
| 3.2 |
| 2g |
| 0.125mol |
答:C的摩尔质量是16g/mol.
点评:本题考查化学反应的有关计算,为高频考点,侧重学生的分析、计算能力的考查,把握过量判断及质量、物质的量与摩尔质量的关系为解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
把50mL 2mol?L-1CuSO4溶液和50mL 1mol?L-1Fe(SO4)3溶液混合,需加入2mol?L-1的BaCl2溶液多少毫升才能使混合溶液中的SO42-全部沉淀?产生沉淀质量多少克?
将2.7gAl与100mL2mol?L-1H2SO4溶液充分反应后,再慢慢滴入25mL4mol?L-1KOH溶液,其结果是( )
| A、得到澄清透明的溶液 |
| B、所得溶液的pH为7 |
| C、取少量所得溶液,加KHCO3,无明显现象发生 |
| D、另取少量所得溶液,加入几滴KOH溶液,有白色沉淀 |
在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气.下列说法正确的是( )
| A、甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 |
| B、甲烧杯中的酸过量 |
| C、两烧杯中生成氢气的速率相等 |
| D、反应开始后乙烧杯中c(H+)始终比甲烧杯中c(H+)小 |


 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: 的流程图:
的流程图: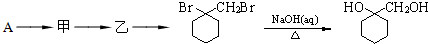 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式:
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: