题目内容
有A、B、C、D、E五种无色溶液,它们分别是Na2CO3、KI、HCl、CaBr2和AgNO3中的一种.将它们两两混合,发生如下反应:
A+B→黄色沉淀;A+E→白色沉淀;A+C→浅黄色沉淀;
C+D→白色沉淀;A+D→白色沉淀;D+E→无色气体.
试推断:A ;B ;C ;D ;E .
A+B→黄色沉淀;A+E→白色沉淀;A+C→浅黄色沉淀;
C+D→白色沉淀;A+D→白色沉淀;D+E→无色气体.
试推断:A
考点:无机物的推断,物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:由A+B→黄色沉淀、A+C→浅黄色沉淀,则黄色沉淀为AgI,浅黄色沉淀为AgBr,A为AgNO3,可知B、C;A+E→白色沉淀、D+E→无色气体,可知E为HCl,以此来解答.
解答:
解:由A+B→黄色沉淀、A+C→浅黄色沉淀,则黄色沉淀为AgI,浅黄色沉淀为AgBr,A为AgNO3,可知B为KI,C为CaBr2;
又A+E→白色沉淀、D+E→无色气体,可知E为HCl,则D为Na2CO3,符合C+D→白色沉淀、A+D→白色沉淀,白色沉淀分别为碳酸钙、AgCl,
故答案为:AgNO3;KI;CaBr2;Na2CO3;HCl.
又A+E→白色沉淀、D+E→无色气体,可知E为HCl,则D为Na2CO3,符合C+D→白色沉淀、A+D→白色沉淀,白色沉淀分别为碳酸钙、AgCl,
故答案为:AgNO3;KI;CaBr2;Na2CO3;HCl.
点评:本题考查无机物的推断,为高频考点,明确物质的性质及发生的反应中的现象是解答本题的关键,注意沉淀的颜色为推断的突破口,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
相关题目
对可逆反应2SO2(g)+O2 (g)?2SO3 (g),下列判断正确的是( )
| A、若单位时间内生成xmolSO3 的同时,消耗xmolSO2,则反应达到平衡状态 |
| B、达到化学平衡状态,2v正(O2)=v逆(SO3 ) |
| C、平衡时,SO2的浓度必定等于O2 浓度的2倍 |
| D、达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 |
下列关于Na2CO3和NaHCO3性质的说法错误的是( )
| A、热稳定性:NaHCO3<Na2CO3 |
| B、与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 |
| C、相同温度时,在水中的溶解性:NaHCO3<Na2CO3 |
| D、等物质的量浓度溶液的pH:NaHCO3<Na2CO3 |
常温下某强酸溶液和某强碱溶液的pH之和为13,将这种酸和这种碱按一定比例混合,溶液恰好呈中性,混合时酸和碱的体积之比是( )
| A、10:1 | B、1:10 |
| C、1:1 | D、1:2 |
海水中含有丰富的氯元素,这些氯元素( )
| A、处于化合态 | B、处于游离态 |
| C、是单质 | D、显正价 |
点燃一根蜡烛,将火焰上方罩一只冷的干燥的烧杯,在烧杯内壁出现水珠,由此得出石蜡的组成中一定含有( )
| A、碳元素 | B、氢元素 |
| C、氧元素 | D、氢、氧元素 |
 有机物A的结构简式如图,有关它的说法中正确的是( )
有机物A的结构简式如图,有关它的说法中正确的是( )| A、A遇FeCl3溶液显紫色 |
| B、A被酸性KMnO4溶液氧化可生成酸酸 |
| C、乙酸与A形成的脂的化学式是C12H14O3 |
| D、A能发生取代、加成、消去、氧化、聚合等反应 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C、向0.2 mol?L-1 NaHCO3溶液中加入等体积0.1 mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol?L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
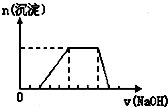 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是