题目内容
1.常温常压下,点燃24moLH2S和30moLO2,氧化产物为S和SO2,物质的量为6mol和18mol.分析 点燃H2S时,氧气少量发生反应:2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,氧气过量时发生反应2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,而2点燃4moLH2S和30moLO2,两种反应都有,设出生成二氧化硫、硫的物质的量,分别根据硫化氢、氧气的物质的量列式计算即可.
解答 解:设反应生成S、二氧化硫的物质的量分别为x、y
2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,
x 0.5x x
2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
y 1.5y y
则:x+y=24、0.5x+1.5y=30,解得:x=6mol,y=18mol,所以氧化产物为S和SO2,物质的量分别为6mol和18mol;
故答案为:S和SO2;6mol和18mol.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,要求学生能够熟练掌握常见反应的化学方程式,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 按系统命名法,化合物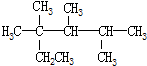 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| B. | 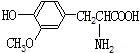 与 与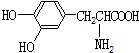 都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 | |
| C. | 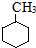 的一溴代物和 的一溴代物和 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一平面上 |
10.下列溶液中离子一定能够大量共存的是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=1的溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
11.如果2克甲烷含有X个甲烷分子,那么22克二氧化碳所含分子数( )
| A. | 4X | B. | 3X | C. | X | D. | 0.5X |
 的名称3,4-二甲基辛烷.
的名称3,4-二甲基辛烷. .
.